
2022 ASCO 会议在 6 月 3 日至 7 日举行。昨晚各重磅研究已经陆续亮相, TIGIT 单抗 Tiragolumab 也在 III 期临床接连受挫之后首次公布了针对广泛期小细胞肺癌(ES-SCLC)的 SKYSCRAPER-02 临床数据,这是全球首项 TIGIT 单抗 III 期研究结果数据。

阿替利珠单抗联合化疗是全球首个获批用于 ES-SCLC 一线治疗的肿瘤免疫疗法,目前期望通过 TIGIT 单抗联用来提高联合疗法的抗肿瘤疗效和生存获益,SKYSCRAPER-02 研究正是基于此开展。遗憾的是,明星药 tiragolumab 的加入并没有扩大 PD-L1 抑制剂 atezolizumab 联合化疗治疗一线 ES-SCLC 的优势。在这篇文章中,笔者回顾本次 ASCO 大会中公布的临床数据,并提供几点思考。

SKYSCRAPER-02 研究数据
首先来看本次公布的临床数据:
SKYSCRAPER-02:阿替利珠单抗(atezo)+ 卡铂 + 依托泊苷(CE)联合或不联合 tiragolumab(tira)在未经治疗的广泛期小细胞肺癌(ES-SCLC)患者 (pts) 中的 III 期、随机、双盲、安慰剂对照研究(临床试验登记号:NCT04256421)
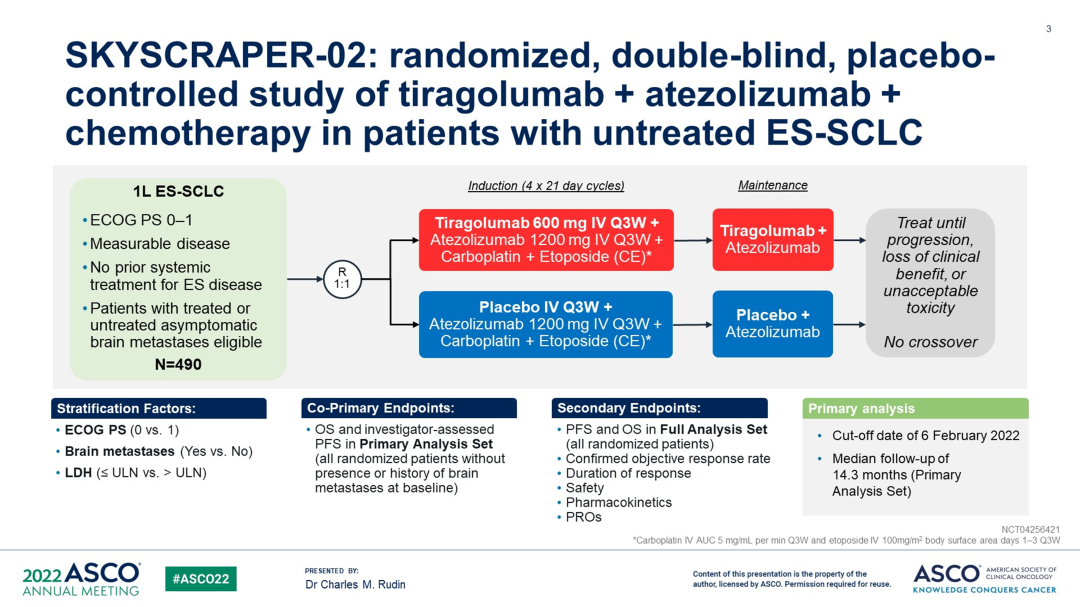
方法:未治疗的 ES-SCLC(允许无症状或未经治疗的脑转移 [BM])的患者按 1:1 随机分配接受 tiragolumab 600 mg IV +Atezolizumab (1200 mg IV,第 1 天) + CE 4 个周期诱导化疗,序贯 tiragolumab +Atezolizumab 维持治疗;或安慰剂 + Atezolizumab + CE,序贯安慰剂+ Atezolizumab 维持治疗,直至疾病进展或未再获得临床获益。
分层因素包括:ECOG PS评分(0 vs 1分);脑转移状态(有 vs 无);LDH(≤正常上限 [ULN] vs>ULN)。共同主要终点是在基线时没有脑转移的所有随机患者中由研究者评估的 PFS 和 OS(主要分析集 [PAS])。其他终点包括所有随机患者的 PFS 和 OS,无论脑转移状态(全分析集 [FAS])、客观缓解率、缓解持续时间和安全性如何。
SKYSCARPER-02 临床设计
来自:2022 ASCO
结果:共有 490 名患者被随机分组(tira + atezo + CE,n=243;pbo + atezo + CE,n=247)。截至 2022 年 2 月 6 日,中位随访时间为 13.9 个月,此次分析为 PFS 的最终分析和 OS 的中期分析。
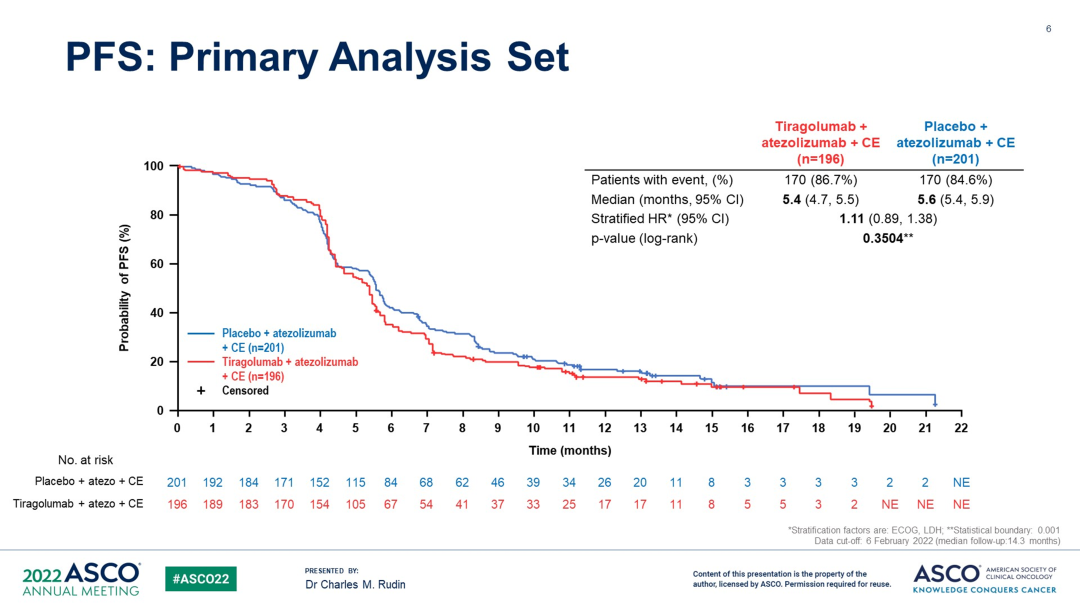
在主要分析集(PAS)中,与安慰剂相比,Tiragolumab 组的 PFS 或 OS 没有额外的获益,中位 PFS 分别为 5.4 个月(95% CI:4.7-5.5) vs. 5.6 个月(95% CI:5.4-5.9),OS 分别为 13.6 个月(95% CI:10.8-14.9) vs. 13.6 个月(95% CI:12.3-15.2),详见下图:
PFS 和 OS 数据(PAS)

来自:2022 ASCO
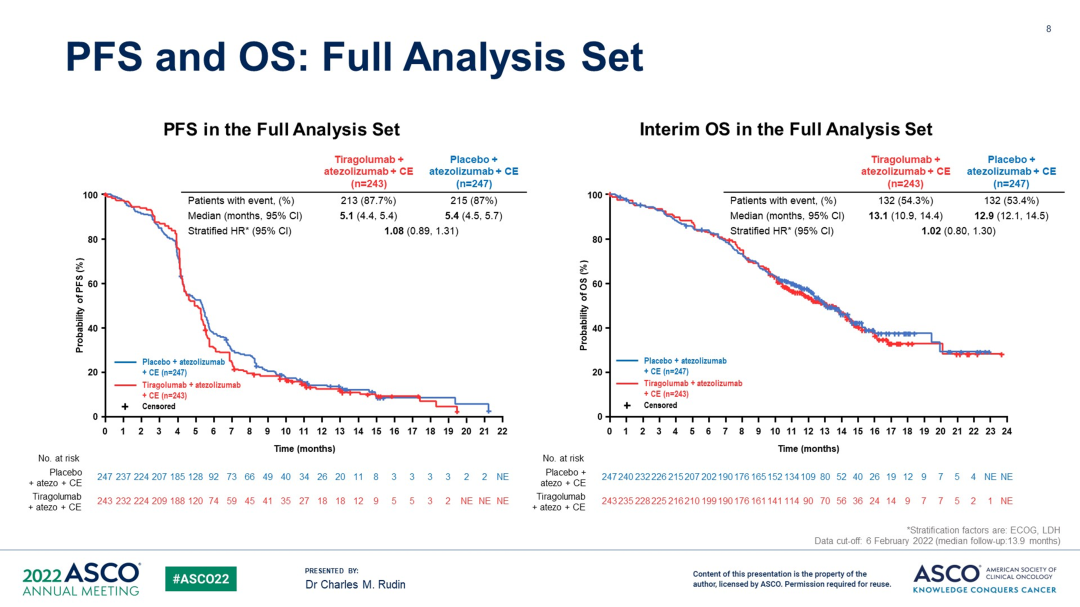
在全分析集(FAS)中,中位 PFS 和 OS 同样未观察到获益。
PFS 和 OS 数据(FAS)
来自:2022 ASCO
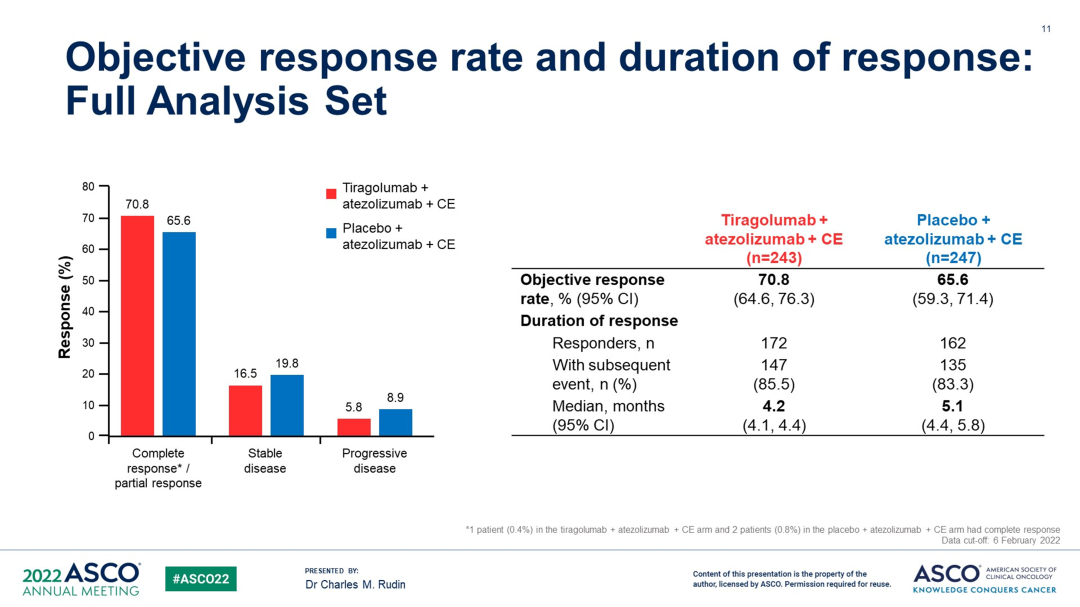
ORR 两组分别为 70.8% (tira + atezo + CE) 和 65.6% (atezo + CE)。
来自:2022 ASCO
安全性方面,3/4 级 TRAE 两组分别为 52.3% (tira + atezo + CE) 和 55.7% (atezo + CE),5 级 TRAE 分别为 0.4% (tira + atezo + CE) 和 2.0% (patezo + CE)。导致任何治疗中止的 TRAE 两组分别为 5.0% (tira + atezo + CE) 和 5.3%(atezo + CE)。
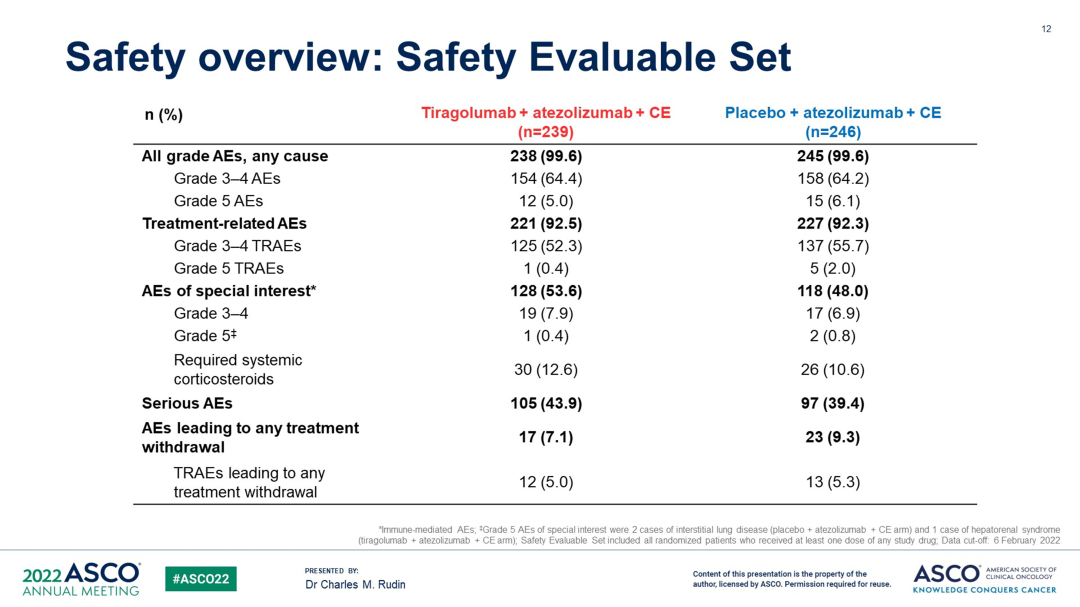
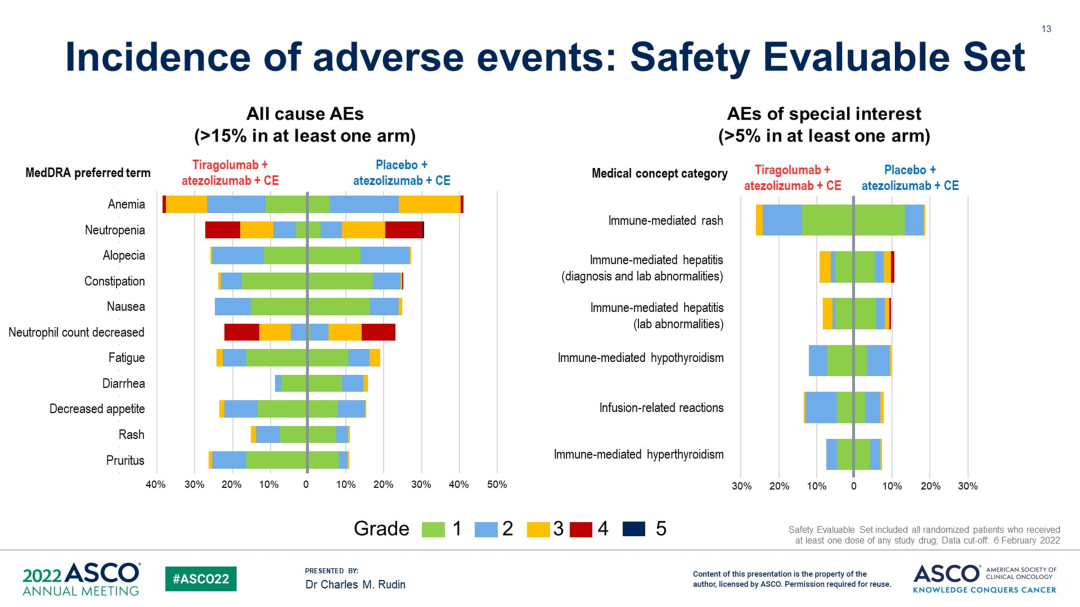
来自:2022 ASCO
结论:对于未经治疗的 ES-SCLC 伴或不伴脑转移的患者,在 atezo + CE 中添加 tira 并没有提供优于 atezo + CE 的临床获益。该组合耐受性良好,未发现新的安全信号。该研究将继续计划最终 OS 分析。

关于 SKYSCRAPER-02 的思考
1、基于 PD-L1 表达或分子亚型选择患者,能否提高研究成功率?
在 SKYSCRAPER-02 研究中,患者的选择没有基于 PD-L1 表达或者分子亚型。虽然既往小细胞肺癌的研究中,PD-L1 表达水平并不能预测一线化疗 + PD-(L)1 抑制剂的疗效。尤其在小细胞肺癌中,PD-L1 倾向于低表达。但是在之前开展的 Tiragolumab 联合阿替利珠单抗一线治疗 PD-L1 阳性(22C3 TPS≥1%)晚期 NSCLC 患者 II 期临床研究 CITYSCAPE(NCT03563716)中,研究结果提示 PD-L1 高表达(22C3 TPS ≥ 50%)亚组患者的临床获益更为显著。
另外,研究发现,SCLC 主要存在 4 种亚型,并由至少 3 种转录调节因子控制:ASCL1,NEUROD1,POU2F3。其中,SCLC-I 亚型约占 ES-SCLC 的 18%,IMpower133 研究显示,该亚型更倾向于从化疗+ICIs 联合治疗中获益。在基线时按分子亚型选择治疗方案可能会提高有效率。
2、单纯免疫检查点抑制剂的叠加,并不能成为突破关键
从作用机制上看,Tiragolumab 联合 PD-(L)1 作用机制之一就是,在肿瘤浸润淋巴细胞(TIL)中,TIGIT 经常与 PD-1 在同一细胞上共表达,同时阻断 TIGIT 和 PD-(L)1 可能增强 NK 细胞的抗肿瘤活性并激活 T 细胞,获得原发性或获得性抗肿瘤免疫效应,并增强 PD-(L)1 单抗疗效。所以,在肿瘤浸润淋巴细胞较少的肿瘤微环境中,只增加 TIGIT 抗体,似乎并不能增加疗效。
在另一个 PD-L1 的 III 期研究中显示,在标准化疗基础上进一步联合 durvalumab,可以使广泛期小细胞肺癌患者获得生存获益,两组 mOS 分别为 12.9 个月和 10.5 个月,HR=0.71;但是,在此基础上进一步联合针对 CTLA-4 的免疫检查点抑制剂 Tremelimumab 对比单纯化疗,获益并不明显,两组中位 OS 分别为 10.4 个月和 10.5 个月,HR=0.81,P=0.02。
综上,在没有 biomarker 的指导下,单纯增加免疫检查点抑制剂,似乎并不能成为 SCLC 治疗突破点。
3、SKYSCRAPER-02 的失败会给 TIGIT 研发蒙上阴影吗?
TIGIT 单抗的两项 3 期临床研究中接连受挫,引起业内对 TIGIT 这个靶点议论纷纷。这些失败是否会给 Tiragolumab 项目、乃至整个 TIGIT 靶点的研究蒙上阴影?笔者认为不会。
首先,在开展 SKYSCRAPER-02 之前,并没有在 SCLC 中开展相关 II 期研究。如果 SKYSCRAPER-02 成功了,那么 Tiragolumab 将成为全球第一个上市的 TIGIT 抗体,如果失败了,也就再次证实了阿替利珠单抗联合化疗在 SCLC 一线的治疗地位。
倒是关于 Tiragolumab 的另一项研究或将成为关键,即 tiragolumab +atezolizumab 与 atezolizumab 单药对比作为一线治疗 PD-L1 高表达的晚期非小细胞肺癌(NSCLC)患者的 III 期 SKYSCRAPER-01 研究。
前不久刚公布该研究没有达到其主要终点之一的无进展生存期(PFS),但这不一定表示转化为总生存期(OS)会失败,毕竟 PFS 一直不算是免疫检查点的优势。
TIGIT + PD-(L)1 抑制剂联合疗法无论在肺癌还是其他瘤种中竞争都是十分激烈的。据 Insight 数据库显示,全球已有 56 个 TIGIT 靶点项目在研,其中 31 款已经进入临床研究,第一梯队的四款已经进入 III 期临床开发,临床开发策略与 Tiragolumab 都比较一致,瞄准了肺癌死磕。不过 Tiragolumab 针对食管鳞癌的 III 期临床也在进行中。
TIGIT 单抗 3 期临床项目
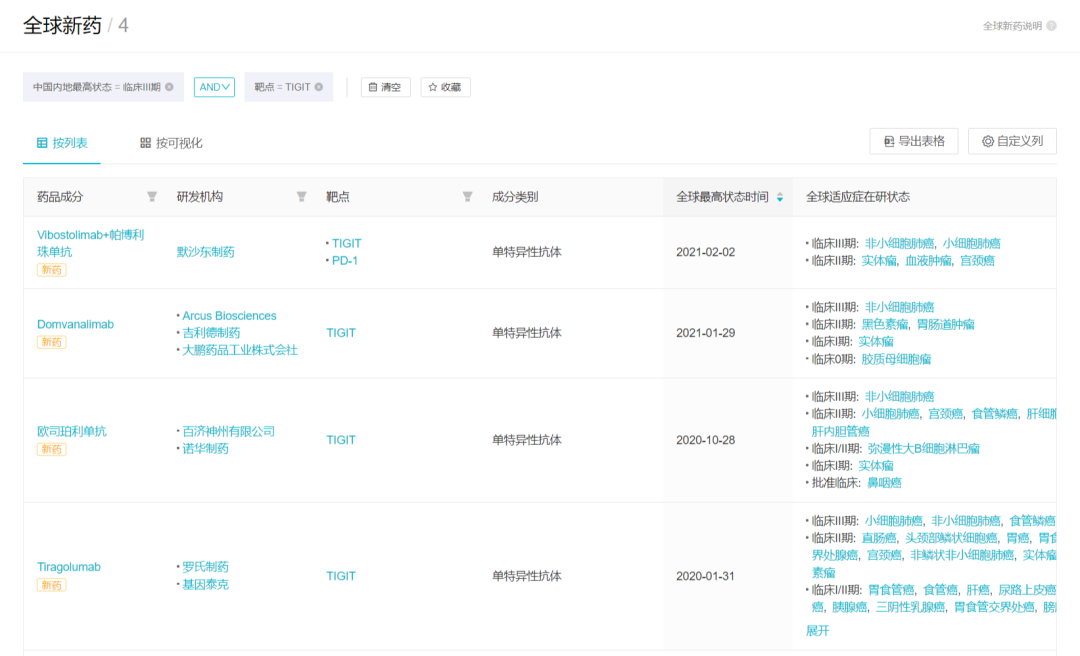
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
SKYSCRAPER-02 给我们更多的提示是,药物研发没有绝对,怎样优效选择试验方案而不是一味跟随,才是临床人更多需要思考的问题。
免责声明:本文来自作者供稿,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
策划:加一
邮箱:yinqihang@dxy.cn