文献题目:Mechanistic convergence of the TIGIT and PD-1 inhibitory pathways necessitates co-blockade to optimize anti-tumor CD8+ T cell responses
中文题目:TIGIT 和 PD-1 通路的共同阻断可优化 CD8+ T 细胞的抗肿瘤反应
研究意义:T 细胞抑制受体,如 CTLA-4、PD-1 和 TIGIT,它们能够抑制抗肿瘤免疫应答,同时也是限制免疫疗法的重要因素。当前,针对这些抑制受体的免疫治疗性抗体,旨在增强和恢复抗原特异性 T 细胞的效应反应,并且该疗法已在部分癌症患者中产生了明确的临床获益。但产生反应的仍然仅限于少数患者,因此极大地限制了其应用。该研究系统探究了 PD-(L)1 或 TIGIT 阻断疗法对 CD8+ T 细胞抗肿瘤反应的内在机制,并发现 CD226 的表达是 PD-(L)1 或 TIGIT 靶向治疗有效性所必需的;同时,PD-1 和 TIGIT 通过不同的机制干扰共刺激受体 CD226 的激活,因此同时阻断 PD-(L)1 和 TIGIT 通路可在癌症免疫治疗中的发挥最佳效果。本研究结果为未来临床联合靶向疗法提供了理论基础,不过仍然需要继续结合临床和临床前研究的数据,以充分理解其潜在机制,以便通过系统和合理的方式优化治疗方案。
T 细胞抑制受体,如 CTLA-4、PD-1 和 TIGIT,它们能够抑制抗肿瘤免疫应答,同时也是限制免疫疗法的重要因素。当前,针对这些抑制受体的免疫治疗性抗体,包括伊匹木单抗、纳武利尤单抗、帕博利珠单抗等,旨在增强和恢复抗原特异性 T 细胞的效应反应,并且该疗法已在部分癌症患者中产生了明确的临床获益。尽管说免疫疗法为癌症患者的治疗提供了新的希望,但产生反应的也仅限于少数患者,因此极大地限制了其应用。考虑到 PD-1、CTLA-4 和 TIGIT 的表达、调节和功能的复杂性,因此,更深入地了解它们与每一种药物的关联及内在相关的机制,有助于揭示哪些药物组合才是最有效的组合。近日,来自美国 Genentech 公司等单位的科研团队在 Immunity 发表了题为 Mechanistic convergence of the TIGIT and PD-1 inhibitory pathways necessitates co-blockade to optimize anti-tumor CD8+ T cell responses 的文章,在这项研究中,他们研究了 PD-(L)1 或 TIGIT 是如何阻断 CD8+ T 细胞对肿瘤的反应,并发现 CD226
的表达是 PD-(L)1 或 TIGIT 靶向治疗有效性所必需的。此外,PD-1 和 TIGIT 通过不同的机制干扰共刺激受体 CD226 的激活,因此同时阻断 PD-(L)1 和 TIGIT 通路可在癌症免疫治疗中发挥最佳效果。总之,本研究结果为未来临床联合靶向疗法提供了理论基础。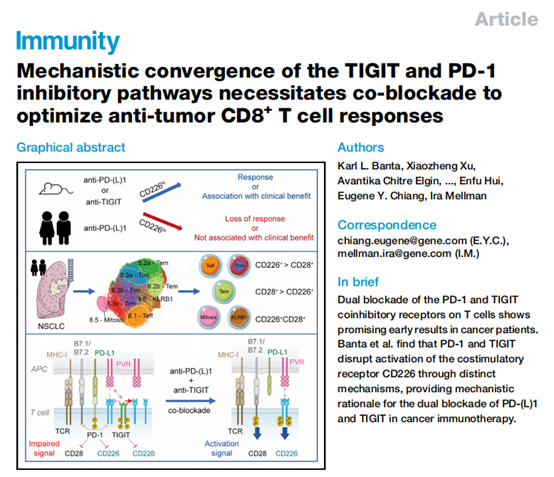
CD226 的缺失降低了 PD-1 或 TIGIT 阻断疗法的抗肿瘤的功效前期的研究发现抗 PD-L1 和抗 TIGIT 联合疗法的抗肿瘤功效被 CD226 阻断的单抗所消除,这表明需要 CD226 和 CD28 的共同刺激才能克服 PD-1 和 TIGIT 的抑制。为了更详细地了解这种关系,研究人员借助 Cd226 敲除小鼠进行了研究。结果发现,与对照组相比,接受抗 PD-1 或抗 TIGIT 疗法的 WT 小鼠的肿瘤生长显著降低;然而,抗 PD-1 或抗 TIGIT 的治疗效果在 Cd226 敲除小鼠中却出现了降低或丧失。此外,他们还评估了 CD226 在介导靶细胞杀伤肿瘤细胞中的作用。将来自 WT 或 Cd226 敲除小鼠的 CD8+ T 细胞与黑素瘤细胞共培养时发现,Cd226 敲除小鼠的 CD8+ T 细胞表现出显著降低的杀伤能力。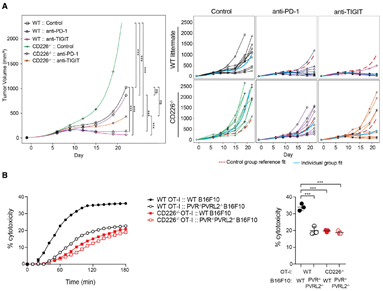
CD226 的表达与抗 PD-L1 免疫治疗的临床反应相关接下来,他们探究了 CD226 的表达是否也是非小细胞肺癌(NSCLC)患者对阿替利珠单抗(一种抗 PD - L1 单抗)的临床反应的决定因素。在多个临床队列中,他们评估了 CD226、CD28、PDCD1、TIGIT 与临床结果的相关性。结果发现,CD226、CD28、PDCD1 和 TIGIT 在每个队列中的表达范围都很广,但是 CD226、CD28 与 TIGIT 更密切相关。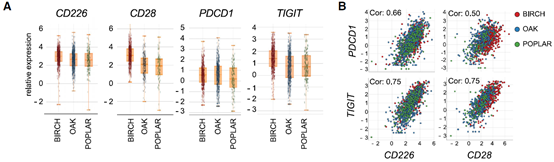
此外,基于肿瘤内 CD226 的表达进行患者分层,发现其表达与总生存期和改善无进展生存期之间存在显著关联;而肿瘤内 CD28 表达的升高与临床获益的改善并无关联;PDCD1 或 TIGIT 的表达也与临床反应无关。总之,这些数据表明 CD226 的表达,而不是 CD28 的表达,与癌症中的抗 PD-L1 治疗的反应相关。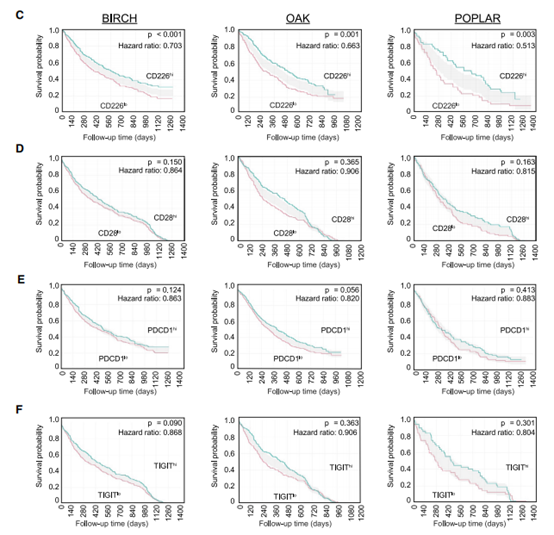
接下来,他们研究了在缺乏 TIGIT 的情况下 PD-1 调控 CD226 磷酸化的能力。之前的研究表明,脂质体重组 PD-1:Shp2 复合物可以对 CD226 的胞内域(ICD)去磷酸化,然而,PD-1 在完整 T 细胞中调控 CD226 磷酸化的程度尚不清楚。他们的研究结果表明,CD226+PD-1+ Jurkat 细胞暴露于 PVR+PD-L1+ Raji 细胞后显示出一定水平的磷酸化。在 PD-1 阻断后,pCD226 水平在 2 分钟和 10 分钟时间点均增加 1.5-2.0 倍,而这种效应依赖于 PVR 与 CD226 的结合,因为当使用 CD226 单抗阻断后可以消除这种效应。因此,这些数据表明 PD-L1 和 PD-1 信号通路可以抑制 PVR 诱导的 CD226 磷酸化。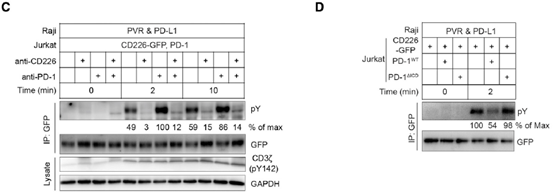
接下来,他们研究了 TIGIT 如何调控 CD226 信号通路。在 Jurkat 细胞中,他们将 WT 的 TIGIT、缺乏 ICD 的 TIGIT 突变体以及全长的 TIGIT 突变体与 CD226 共表达。在加入 PVR+ Raji 细胞后,WT-TIGIT 和 TIGIT 突变体对 pCD226 的抑制程度相似。因此,与 PD-1 相比,TIGIT 对 pCD226 的抑制作用是不存在的。综上所示,PD-1 通过 ICD 来抑制 CD226 的磷酸化,而 TIGIT 对 pCD226 的抑制作用则不存在,这可能是由于 TIGIT 的磷酸化效率低下所致。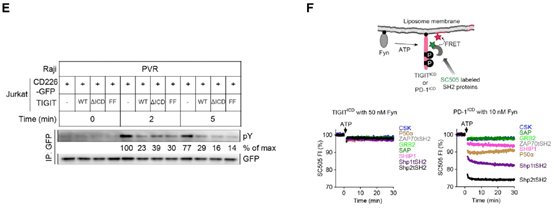
综上所述,本研究揭示了共刺激和共抑制受体之间的相互作用,并将 CD226 作为一个可能预测和决定免疫检查点阻断疗法成功的中心角色。CD226 是一种激活受体,多个检查点抑制剂途径在其上聚合,因此可能是产生最佳抗肿瘤效应的关键。同时,这项研究的结果也有助于定义临床中 TIGIT 与 PD-1 或 PD-L1 阻断结合的机制:CD226 和 CD28 都是 PD-1 介导免疫抑制的共刺激分子,但由于 TIGIT 的存在,PD-1 或 PD-L1 阻断可能不能充分释放 CD226 活性;相反,单独抗 TIGIT 也不能释放被 PD-1 介导的 CD226 和 CD28 抑制。因此,最佳的激活 CD8+ T 细胞的肿瘤反应性可能需要同时抑制 TIGIT 和 PD-1。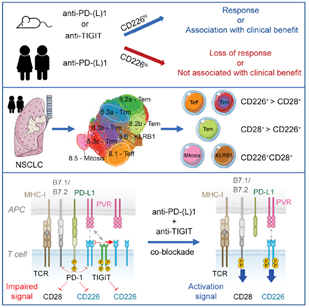
总之,他们研究了 PD-1 和 TIGIT 阻断疗法调节 CD8+T 细胞抗肿瘤的机制,并发现同时阻断 TIGIT 和 PD-1 可发挥 CD8+ T 细胞最佳的抗肿瘤效应,这为临床联合靶向疗法提供了理论基础。但该疗法目前仍然处于临床前研究,因此未来仍然需要继续结合临床和临床前研究的数据,以充分理解其潜在机制,以便通过系统和合理的方式优化治疗方案。文献链接:https://doi.org/10.1016/j.immuni.2022.02.0051. Banta et al. (2022). Mechanistic convergence of the TIGIT and PD-1 inhibitory pathways necessitates co-blockade to optimize anti-tumor CD8+ T cell responses, Immunity.2. Miller et al. (2019). Subsets of exhausted CD8+ T cells differentially mediate tumor control and respond to checkpoint blockade. Nat. Immunol. 20, 326–336.
3. Yost, K.E., Chang, H.Y., and Satpathy, A.T. (2021). Recruiting T cells in cancer immunotherapy. Science 372, 130–131.