局部进展期胃癌(LAGC)的特点是浸润深度超出黏膜下层,淋巴结转移率高,临床预后差,准确的术前N分期是LAGC个体化治疗的基础之一。不同N分期患者预后差异显著,可能需要不同程度的淋巴结切除术或新辅助治疗。由北京大学肿瘤医院季加孚教授、广东省人民医院刘再毅教授和西安电子科技大学田捷教授共同作为通讯作者的一项基于深度学习放射组学预测LAGC的N分期研究,结果于近期发表在国际经典肿瘤学临床期刊《肿瘤学年鉴》(Annals of Oncology)上。

主任医师、博士生导师
北京肿瘤医院院长
国内著名消化道肿瘤外科学专家
中国抗癌协会胃癌专业委员会主任委员
根据第八版美国癌症联合委员会(AJCC)TNM分期系统,淋巴结(LN)受累的严重程度根据LNM的数目分为N0(无LNM)、N1(1-2 LNM)、N2(3-6 LNMs)、N3a(7-15 LNMs)和N3b(>15 LNM)。准确的术前N分期是LAGC个体化治疗的基础之一。不同N分期患者预后差异显著,可能需要不同程度的淋巴结切除术或新辅助治疗。欧洲前瞻性随机Dutch试验显示,在N2期LAGC患者中,扩大淋巴结切除术(D2)比限制性淋巴结切除术(D1)有更高的生存率。欧洲医学肿瘤学学会(ESMO)和国家综合医院癌症网络(NCCN)指南建议通过临床影像学进行术前N分期。尤其是CT成像已被常规用于术前N分期,LNs增大且呈圆形是LNM的标志。然而,对于LNM,CT的准确率在50%-70%之间,这是不够理想的。
放射组学是一种新兴的技术,它将标准的医疗图像转换为手工制作的放射特征,然后选择关键特征用于量化癌症诊断。放射列线图这种结合放射影像学特征和临床特点的影像学模型,提高了LAGC腹膜转移的预测能力。结合从卷积神经网络自动学习的深度学习特性,放射组学在癌症方面表现出了出色的预后预测价值。但是,利用深度学习放射组学预测LAGC的N分期尚未见报道。
基于此,本研究旨在为LAGC的N分期开发一个深度学习的放射列线图(DLRN)。研究人员将重点放在术前鉴别病理性N0、N1、N2、N3a和N3b,因为准确的分期是个体化治疗的基础。
研究人员从中国5个中心和意大利1个中心收集730例LAGC患者,并将其分为1个初级队列(PC)、3个外部验证队列(VC1、VC2和VC3)和1个国际验证队列(IVC)。根据多期CT图像建立DLRN,以确定LAGC中LNM数目。研究人员对DLRN进行了全面测试,并与3种最先进的方法进行了比较。此外,研究人员还探讨了DLRN在生存分析中的价值。
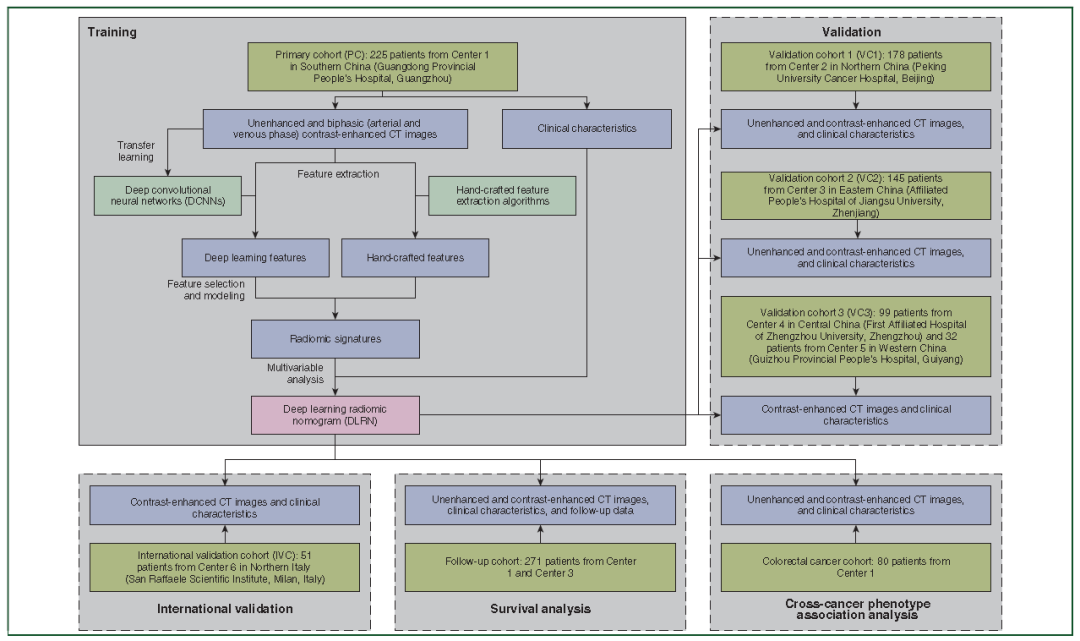
图1.研究流程图
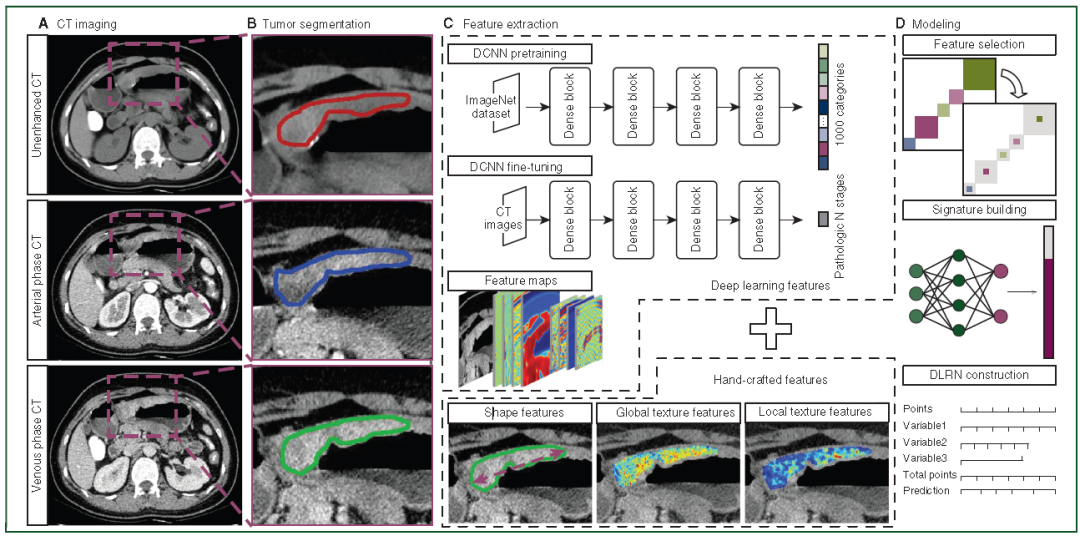
图2. LAGC患者N分期的深度学习放射学DLRN建模流程
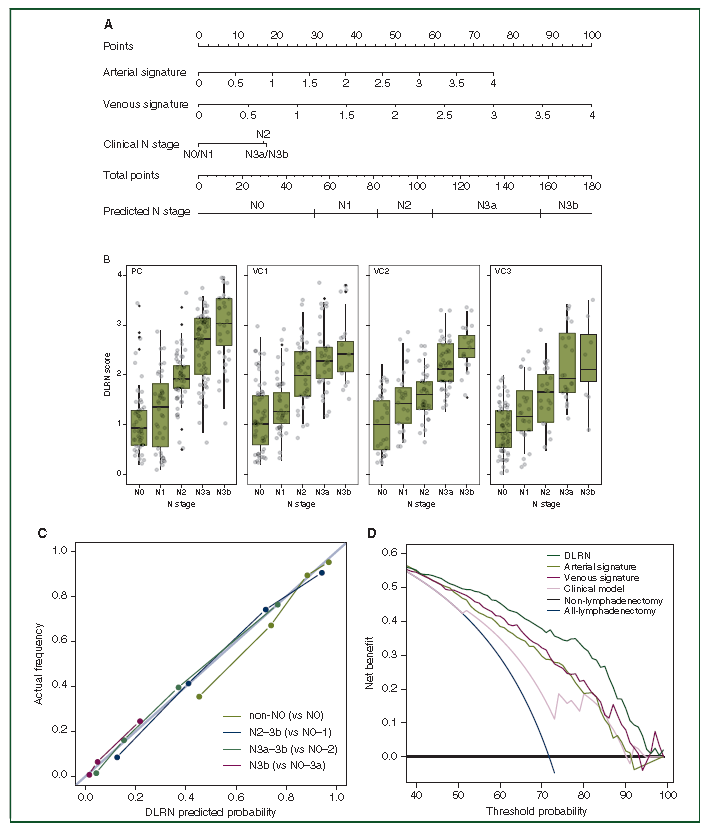
图3.DLRN及其表现
如图3A所示,具有两个对比增强放射学特征和临床N期的DLRN,根据top‘points’bar,尺度为0-100,分别获得动脉特征点、静脉特征点和临床N分期。然后,将这三点加起来计算总分。预测的N分期是通过将总点映射到“总点”杆和“预测的N分期”杆得到的。DLRN评分与病理N期之间存在显着的正相关性。图3B 为PC、VC1、VC2和VC3中病理N分期与DLRN的相关模式的箱图。亚组分析的校准曲线显示DLRN预测结果与实际N阶段之间具有良好的一致性。非N0与N0、N2-3b与N0-1、N3a-3b与N0-2、N3b与N0-3a亚组分析中DLRN的校准曲线(图3C)。利用DLRN、动脉特征、静脉特征、临床模型、非淋巴结清扫方案、全淋巴结清扫指导淋巴结清扫的决策曲线分析计划(图3D)。如果研究人员使用此模型指导淋巴结清扫术(非N0患者接受淋巴结清扫术,而N0患者则不接受),则决策曲线表明DLRN给患者带来的获益多于通过单一特性,临床模型,非淋巴结清扫术方案和全淋巴结清扫术方案进行决策。
研究者评估了在LAGC队列随访中DLRN的预后价值,DLRN对OS的预测精度(C指数 0.646,95% -CI 0.596-0.696,P<0.0001)。DLRN评分高的患者OS表现较差(HR=1.982,95%CI 1.592-2.467,P<0.0001)。如图4所示,由中值DLRN评分拉开的kaplan-Meier曲线有显著差异(log-rank检验P<0.0001)。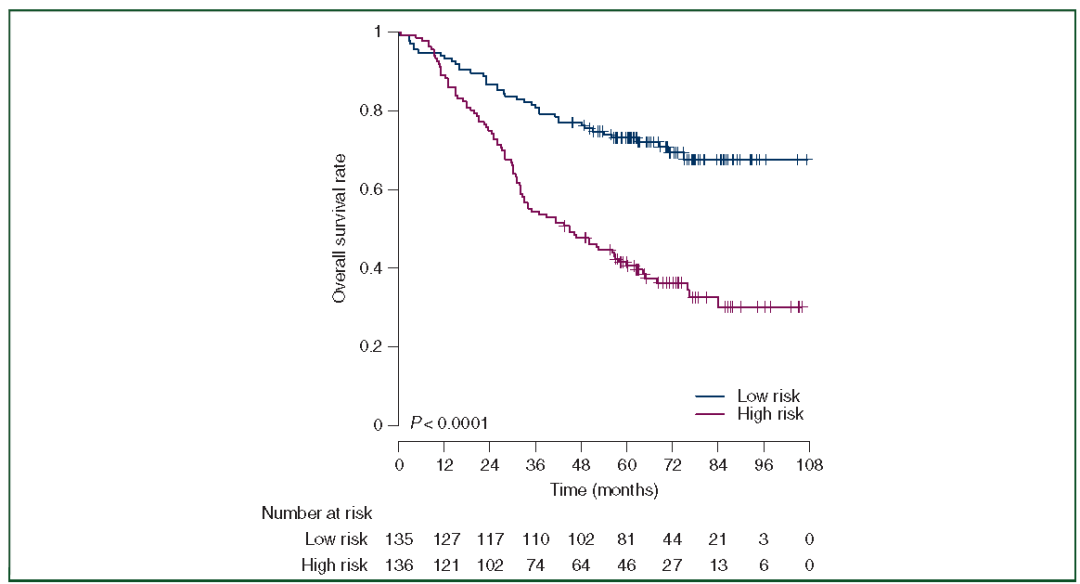
图4. LAGC随访组总生存率的kaplan-Meier生存曲线
这项研究是一项国际多中心合作,旨在预测LAGC中LNM的数量。研究人员的DLRN在不同中心显示出很高的预测能力和可重复性。此外,在正常的报告时段内,每位患者的ROI细分和DLRN分数计算仅需要不到5分钟的时间,这使得DLRN成为临床医生易于使用的工具。
该研究有一些限制。首先,这项研究涉及大量来自中国的患者,但也有少量来自意大利的患者。应该对其他亚洲和大规模非亚洲人口进行进一步的前瞻性研究。其次,胃癌在不同国家或种族中可能具有不同的病因和生物学特征。这如何影响研究人员的列线图尚不清楚。但是,将来自不同国家/地区的患者混合在一起进行深度学习可能会改善模型的性能。第三,除CT外,还推荐内镜超声检查进行N分期,将内镜超声检查与CT结合使用可提高N分期的准确性。第四,使用单个切片中的2D特征而不是3D特征。尽管该操作对放射科医生而言更为方便,但2D分割可能无法代表整个肿瘤,并且2D与3D可能会影响某些功能。最后,具有微卫星不稳定性的胃癌(约10%)不太可能患有LNM,但可能会出现免疫细胞浸润所致的LNs增大,其对列线图的影响待进一步研究。
综上,DLRN在所有队列中对LNM的数量都有很好的识别能力[总体C指数(95% CI):初级队列中0.821(0.785-0.858),外部验证队列中的0.797(0.771-0.823)和国际验证队列0.822(0.756-0.887)]。列线图的性能明显优于常规使用临床N分期,肿瘤大小和临床模型(P<0.05)。此外,DLRN与LAGC患者的总体生存率显著相关(n= 271)。
基于深度学习的放射列线图对LAGC的LNM有较好的预测价值。在胃癌的分期治疗中,这种术前列线图可以为LAGC的个体化治疗提供基线信息。
Dong D, Fang MJ, Tang L, et al. Deep learning radiomic nomogram can predict the number of lymph node metastasis in locally advanced gastric cancer: an international multicenter study. Ann Oncol,2020;31(7):912-920.

版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。