
各位小伙伴好呀!我是酷爱分享生信前沿思路的馆长!单细胞RNA测序(scRNA-seq)与机器学习技术大家都不陌生吧!这两种技术的结合为生物医学研究带来革命性的突破,它们的融合既克服传统转录组测序的局限性,又提升数据分析和解读的能力,强强联合必定能拿下高分!
馆长今天要向大家分享这篇发表在《Biomarker Research》(IF=9.5)的题为“Single-cell and bulk RNA-seq unveils the immune infiltration landscape associated with cuproptosis in cerebral cavernous malformations”文章,便利用机器学习联合单细胞RNA测序,为脑海绵状血管瘤(CCMs)的诊断和治疗提供了新的分子靶点!现在跟着馆长一起走近这篇文章,看看它究竟有怎样的魅力吧~
1.本研究揭示了两种不同的CCM亚型,它们在CRG表达模式和免疫浸润方面存在差异。鉴定并验证三个枢纽基因(BTBD10、PFDN4和CEMIP),它们可能与CCMs的发病机制显著相关。
2.本研究结合单细胞RNA测序和机器学习算法,通过综合分析大量数据,干湿结合,探讨表达枢纽基因的EC亚群与免疫细胞(特别是M2型巨噬细胞)之间的细胞-细胞通信,表明这些相互作用和铜死亡在CCMs发病机制中的关键作用。PS:想让你的研究课题精准命中,论文发表如探囊取物?别急,馆长来帮忙!各种生信分析一网打尽,而且还有物美价廉的机器学习课程为你助攻!)
定制生信分析
云服务器租赁
加好友备注“99”领取试用

题目:单细胞和bulk RNA揭示与脑海绵状血管瘤中铜死亡相关的免疫浸润景观
杂志:Biomarker Research
影响因子:IF=9.5
发表时间:2024年6月
公众号回复“666”领取原文PDF,文献编号:240717
研究背景
脑海绵状血管瘤(Cerebral cavernous malformations,CCMs)是一种常见的神经血管畸形。这些畸形已被广泛研究,但其起源和不同年龄组的患病率仍在考虑之中。目前已确定CCM1(KRIT1)、CCM2(MGC4607)和CCM3(PDCD10)三个基因参与CCMs的发展,基因和遗传危险因素参与血管发生、血管生成和血管重塑。然而,导致CCMs发病的确切机制尚不清楚,治疗方法尚未确定。
铜死亡,也被称为铜诱导死亡,是一种与线粒体代谢相关的新型细胞死亡形式。胞内铜通过刺激线粒体相关蛋白的硫辛酰化聚集过程,促进Fe-S簇蛋白的降解及蛋白毒性反应,最终导致细胞死亡。本研究旨在研究与CCMs发展相关的一种新发现的细胞死亡类型铜死亡的分子特征。
研究思路
本文首先对15个CCM样本和6个对照样本进行RNA测序(RNA-seq),通过共识聚类分析,基于铜死亡相关基因(CRGs)的表达水平将CCMs分为两个亚型。然后识别不同亚型之间的差异表达基因和免疫浸润。采用最小绝对收缩、选择算子和随机森林等机器学习算法筛选与CCMs相关的铜死亡中心基因。此外,使用通路富集和相关性分析探索枢纽基因的功能及其与CCMs中免疫表型的关联。然后使用外部数据集进行验证。最后,使用Cellchat算法探究这些枢纽基因在CCMs细胞-细胞通信中的潜在作用机制。研究流程图如图1所示:

图1研究流程图
研究结果
1.CCMs的特征和功能改变以及CCMs组织中CRGs表达和免疫浸润分析
研究人员分析来自21例患者(6例对照组和15例CCMs组)的表达谱数据(图2A),发现CCMs与对照组之间共有2963个DEG,其中CCMs中有1169个基因上调,1794个基因下调(图2B)。上调的基因主要富集在与免疫和血管生成相关(图2C)。为进一步研究CRGs在CCMs中的表达模式,随后的列表仅限于GSE130174和GSE123968中具有人类大体积RNA表达数据的基因。研究结果表明,在对照组和CCMs组中,CDKN2A、GLS、PDHA1和PDHB四种铜死亡基因表现出显著的表达差异(图2D-F)。具体来说,CDKN2A在CCMs中高表达,而GLS、PDHA1和PDHB在对照组中高表达。值得注意的是,与对照组相比,FDX1和LIAS在CCMs中的表达有所增加,但差异无统计学意义(图2E,F)。此外,对CRGs进行相关性分析,以探讨CRGs在CCMs发展中的作用。值得注意的是,FDX1与CDKN2A和DLD呈正相关,GLS与CDKN2A和FDX1呈负相关,LIAS与GLS呈负相关,LIPT1与CDKN2A、FDX1、MTF1呈正相关,与GLS呈负相关,CDKN2A与PDHA1和PDHB呈正相关(图2G)。鉴于CCMs中上调的DEG主要富集于CCMs中的免疫调节(图2C),研究人员用CIBERSORT分析来评估样品的免疫浸润。分析结果显示,与对照组相比,CCMs中有显著的免疫细胞浸润,包括巨噬细胞、树突状细胞(DC)、B细胞和T细胞(图2H)。对CRGs与免疫细胞的关系分析显示,大多数CRGs与CCR(C-C趋化因子受体)、T细胞共刺激、APC(抗原提呈细胞)共刺激DC和Tfh (T滤泡辅助细胞)呈正相关。相反,它们与APC共抑制、亚炎症、Treg(调节性T细胞)、I型IFN反应、TIL(T肿瘤浸润淋巴细胞)、HLA(人类白细胞抗原)和巨噬细胞呈负相关(图2I)。
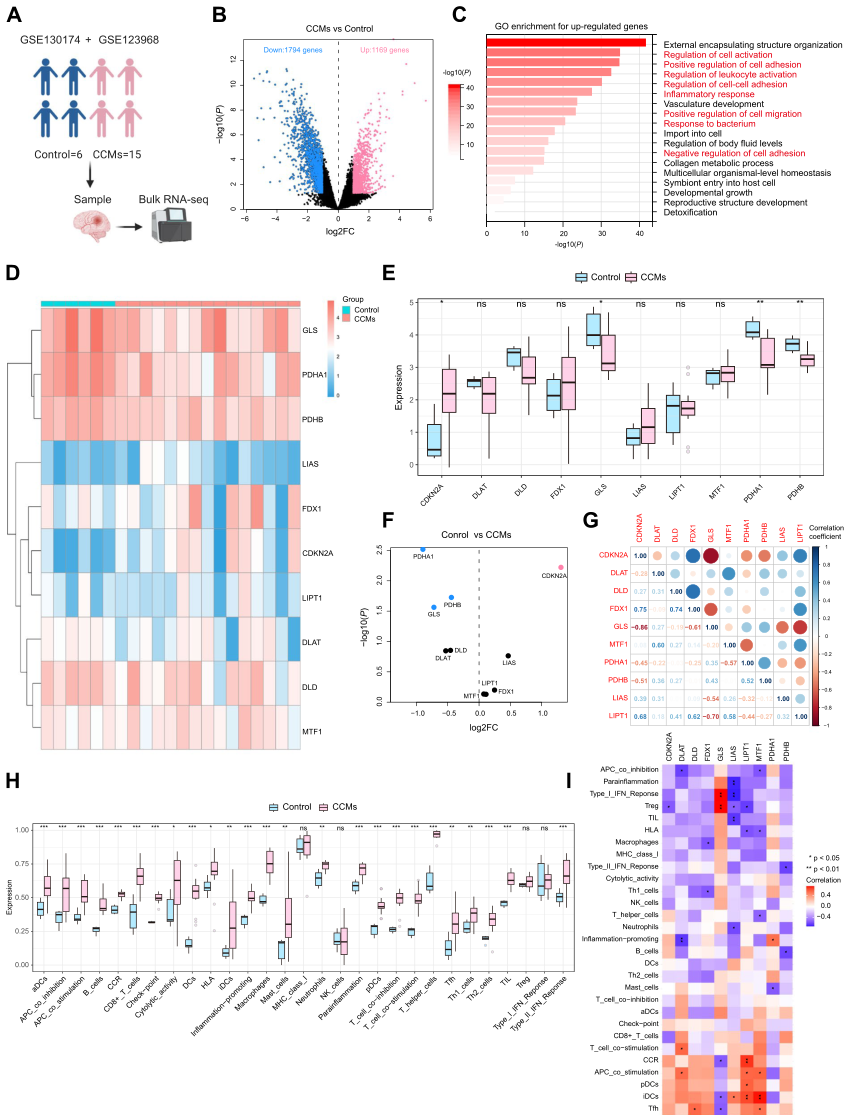
图2 对照组和CCMs组中表达的CRGs。
2.基于CRGs表达的一致性聚类CCMs及团簇间功能富集
在评估CRGs表达差异的基础上,研究人员采用共识聚类方法来研究CCMs铜死亡的修饰模式。分析结果显示,在k=2时,两个样本簇之间的区别更加明显,从而建立两个不同的簇(图3A-F)。绘制火山图来描述两个集群之间的DEG分布,在集群1与集群2中,DEG由281个上调基因和266个下调基因组成(图3G)。GO富集分析显示,DEG主要富集于免疫调节、血管发育和突触中(图3H)。进一步研究这些集群中CRGs的表达,鉴定出7个差异表达的基因(图3I)。具体来说,CDKN2A、FDX1、GLS、LIAS、LIPT1、PDHA1和PDHB在两个簇中表现出不同的表达模式。CDKN2A、FDX1、LIAS、LIPT1在集群1中高表达,GLS、PDHA1、PDHB在集群2中高表达。由于FDX1和LIAS在铜诱导的细胞死亡中起着显著的正向调节作用,而GLS起着负向调节作用,因此在第1组中FDX1和LIAS高表达的患者可能更容易经历铜死亡的正向促进,而在第2组中GLS高表达的患者可能获得相反的调节作用。为探究样品中两个基因簇的功能,研究人员通过GSEA富集分析去鉴定每个簇的富集基因集。选择集群1和集群2的20个最重要的途径进行热图绘制以突出每个亚型中富集的不同途径(图3J,K)。值得注意的是,在GO富集的GSEA中,集群1的基因高表达组中葡糖醛酸转移酶活性被显著激活,而集群2的基因高表达组中腺苷酸环化酶结合被激活(图3J)。在KEGG富集的GSEA中,抗坏血酸盐和醛酸盐代谢、糖和葡萄糖酸相互转化以及细胞色素P450对外源生物的代谢主要富集于集群1的基因高表达组,而糖基磷脂酰肌醇GPI锚定生物合成和柠檬酸循环TCA循环富集于集群2的基因高表达组(图3K)。值得注意的是,这些涉及线粒体能量转移和代谢的途径可能参与调节主要发生在线粒体中的铜死亡。
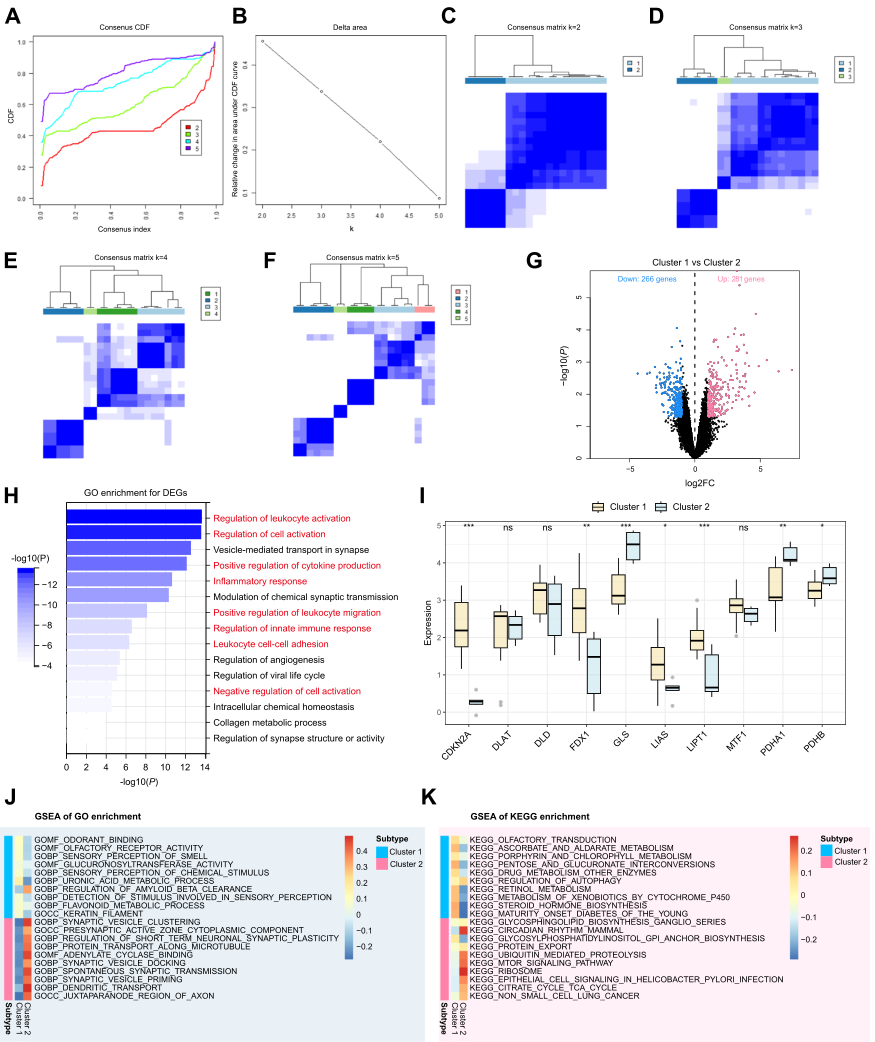
图3 铜死亡相关分子亚型鉴定及综合途径富集分析。
3.枢纽基因与不同亚型CCMs相关
研究人员进一步从集群1与集群2和对照与CCMs中精心选出273个相交的DEG,以筛选与CRGs聚类的CCMs不同亚型相关的特征中心基因(图4A)。筛选过程采用LASSO回归和随机森林算法。通过LASSO回归分析,共鉴定出14个与CCMs相关的特征基因(图4B-C)。随机森林算法选择一组10个特征基因(图4D),然后与LASSO回归算法得到的特征基因相交,得到三个重叠基因的最终列表,即PFDN4、CEMIP和BTBD10(图4E),作为即将进行的研究的枢纽基因。通过比较两个集群发现BTBD10和PFDN4在集群1中高表达,而CEMIP在集群2中高表达。此外,这三个基因在CCMs中均显著过表达(图4F-G)。使用GeneCards数据库鉴定与CCMs相关的致病基因的不同表达水平。B-Raf原癌基因、丝氨酸/索氨酸激酶(BRAF)、T肿瘤坏死因子(TNF)、突触Ras GTPase激活蛋白1(SYNGAP1)、δ-样典型缺口配体4(DLL4)和ATRich相互作用域1B(ARID1B)在集群1中高表达;磷酸肌苷-3-激酶调控亚基2(PIK3R2)、核受体亚家族2F组成员2(NR2F2)、转化生长因子β1(TGFB1)和Zic家族成员1(ZIC1)在集群2中高表达(图4H)。此外,三个枢纽基因的表达水平与各种疾病相关基因表现出显著的相关性。这包括BTBD10和DLL4之间显著的正相关,PFDN4和内啡肽(ENG)之间显著的负相关(图4I)。此外,CEMIP与TGFB1呈正相关,BTBD10和PFDN4的表达模式与CCMs致病基因基本一致,而与CEMIP相反。
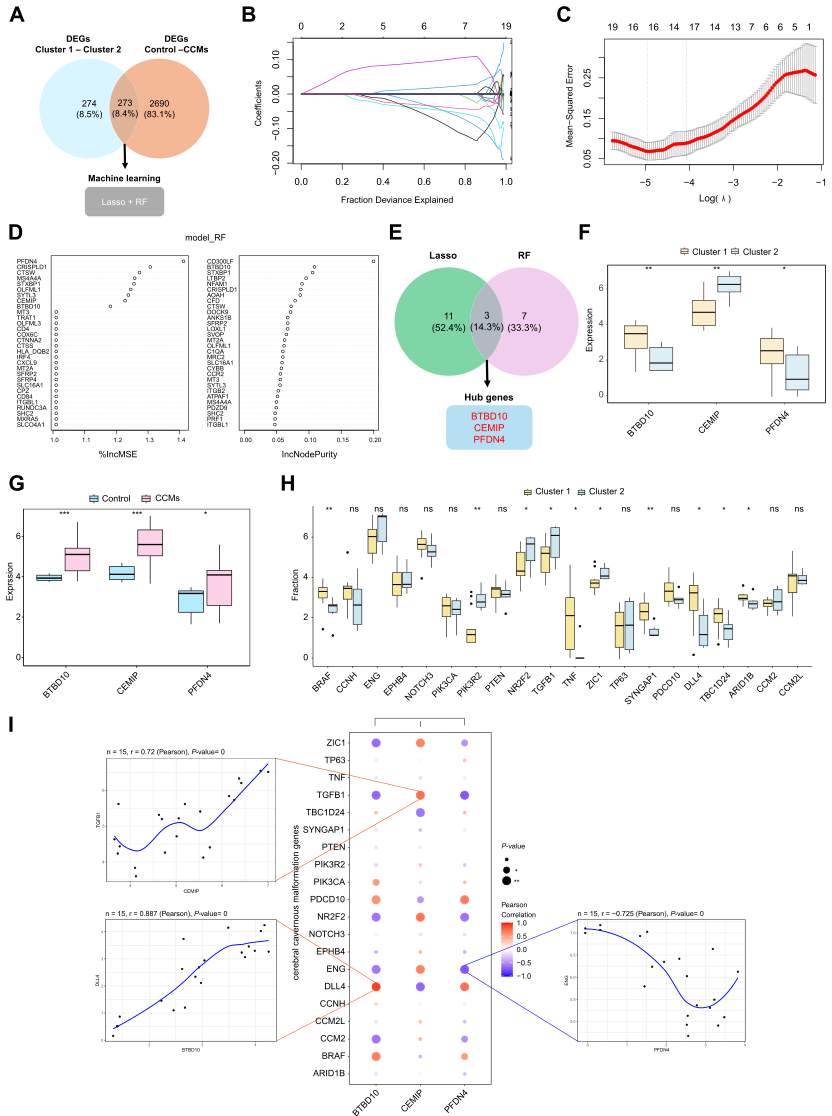
图4 两个CCMs集群中CRGs相关枢纽基因的鉴定。
4.CCMs亚型的免疫浸润特征
免疫微环境主要由免疫细胞、细胞外基质、各种生长因子、炎症因子等组成,具有独特的物理化学特征。这些因素显著影响CMMs的发展或出血。研究人员通过ssGSEA进行初步分析两个簇与免疫浸润之间的相关性来研究促进CCMs进展的潜在分子机制。在簇1和簇2之间的多种免疫细胞中观察到统计差异,包括活化树突状细胞(adc)、B细胞、检查点细胞、dc、促炎细胞、巨噬细胞、中性粒细胞、浆细胞样树突状细胞(pDCs)、T细胞共抑制、T辅助细胞、TIL和II型IFN反应且簇2均表现出明显高于簇1的免疫浸润水平(图5A)。使用CIBERSORT算法对ssGSEA的结果进行验证,得到一致的结果(图5B)。值得注意的是,巨噬细胞,特别是M0和M2型,在CIBERSORT评估的所有免疫细胞中占很大比例(图5C)。此外,研究枢纽基因与免疫细胞之间的相关性,发现来自集群1的枢纽基因BTBD10和PFDN4与大多数免疫细胞(包括巨噬细胞和B细胞)呈显著负相关(图5D-F)。相反,来自集群2的枢纽基因CEMIP与大多数免疫细胞呈显著正相关(图5E)。分析表明,来自两个簇的枢纽基因与免疫细胞浸润程度密切相关,表明它们在CCMs亚型的免疫微环境中起重要作用。
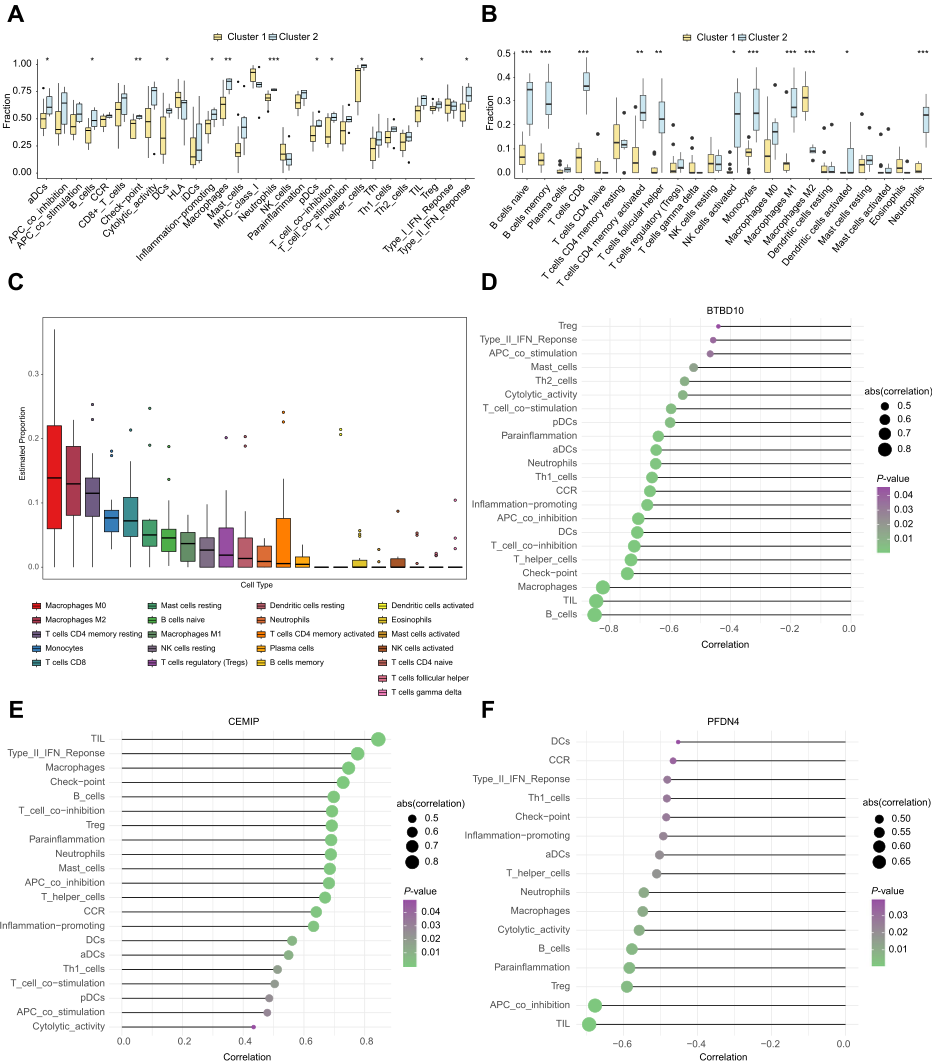
图5 2个CCMs群枢纽基因免疫浸润分析。
5.枢纽基因的信号通路富集
研究人员分析三个中心基因富集的信号通路,以研究它们影响CCMs进展的潜在分子机制。GSVA结果表明,BTBD10在高表达时主要激活mTORC1、脂肪酸代谢、Hedgehog和PI3K-ATK-MTOR信号通路,表明CEMIP表达升高主要富集于IL6/JAK/STAT3、血管生成、通过NFκB的TNFA信号通路和炎症反应信号通路(图6A-B)。同时,在胆汁酸代谢、KRAS信号传导和脂肪酸代谢中发现PFDN4表达显著富集(图6C)。GSEA分析结果表明,BTBD10在趋化因子、NOD样受体和T样受体信号通路中富集(图6D);CEMIP在cAMP信号通路、谷氨酸能突触和逆行内源性大麻素信号通路中富集(图6E);PFDN4在钙信号通路、cAMP信号通路和神经活性配体-受体相互作用中富集(图6F)。这些研究结果表明,hub基因可以通过调节血管内皮生长、炎症反应、线粒体能量代谢和细胞周期来显著影响CCMs的进展。

图6 BTBD10、CEMIP、PFDN4上调和下调激活通路的GSVA和GSEA分析。
6.人内皮细胞枢纽基因的验证
考虑到血管生成背景下CCMs的相关性,研究人员选择包含大量人类ECs RNA-seq数据的GEO数据集(GSE233210)验证枢纽基因在人ECs中的表达和功能(图7A)。在CCMs_EC和对照组的比较中,共鉴定出149个基因表达上调,9726个基因表达下调(图7B)。GO分析发现上调的DEG富含与免疫调节和血管发育相关(图7C)。CRGs表达方面,CCMs_ECs组CDKN2A、FDX1和LIAS上调,而对照组GLS、MTF1和PDHB上调(图7D)。因此,CCMs_ECs组似乎表现出更多与铜死亡相关的特征。同时,研究人员发现中枢基因BTBD10、PFDN4和CEMIP在CCMs_ECs中显著上调(图7E)。进一步对CCMs_ECs组的枢纽基因与CRGs进行相关性分析。结果显示,BTBD10在与CRGs的关系分析中与PFDN4表达一致,与FDX1、LIAS、DLAT呈显著正相关,与GLS、PDHA1呈显著负相关(图7F)。值得一提的是,CEMIP与BTBD10、PFDN4呈相反的相关结果,与FDX1、LIAS、DLAT呈显著负相关,与GLS、PDHA1呈显著正相关。免疫浸润分析结果显示,CCMs_ECs组免疫细胞浸润较高(图7G)。hub基因与免疫细胞的相关性分析显示,BTBD10和PFDN4与大多数免疫细胞呈负相关,而CEMIP与免疫细胞呈正相关(图7H-J)。有趣的是,BTBD10和PFDN4与M2巨噬细胞呈正相关,而与M1巨噬细胞呈负相关(图7H和J),而CEMIP呈相反的相关模式(图7I)。
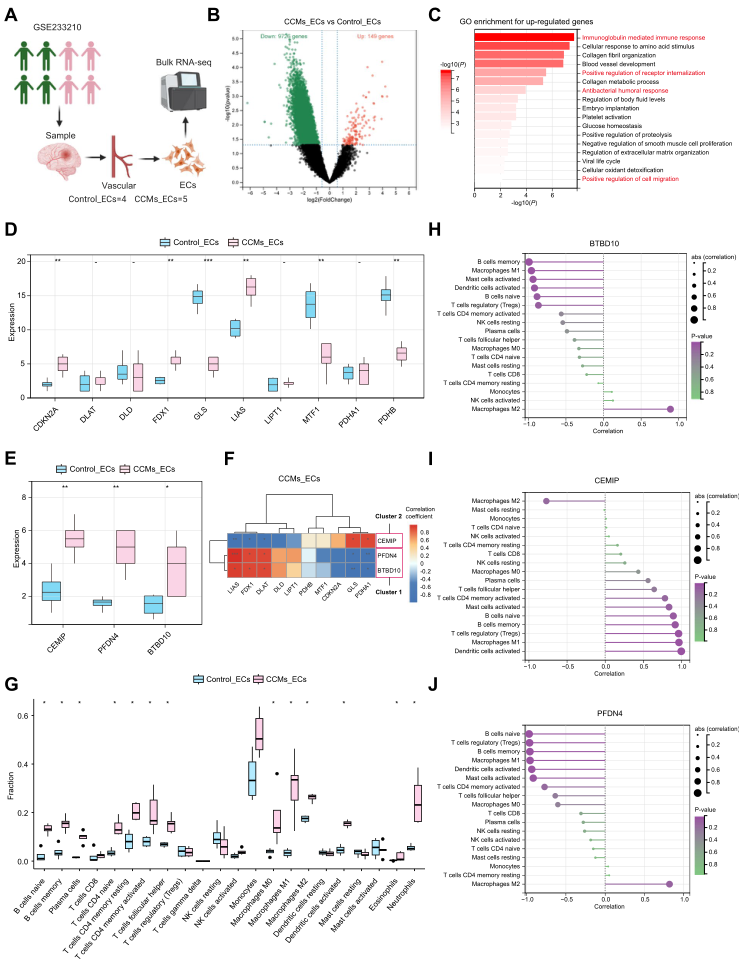
图7 使用来自人类CCMs ECs的外部大量RNA-seq数据集验证中心基因。
7.HS队列枢纽基因的验证
为进一步确定这三个中心基因在CCMs中的实际表达,研究人员进行免疫荧光共定位并评估HS-队列CCMs样本中的蛋白表达水平。在CCMs组织中可观察到BTBD10、CEMIP和PFDN4与VE-钙粘蛋白(ECs的独特标记物)共定位(图8A)。与对照组相比,CCMs组的BTBD10、CEMIP和PFDN4水平显著升高,这表明这些枢纽基因在CCMs组织中具有功能性表达(图8B-E)。
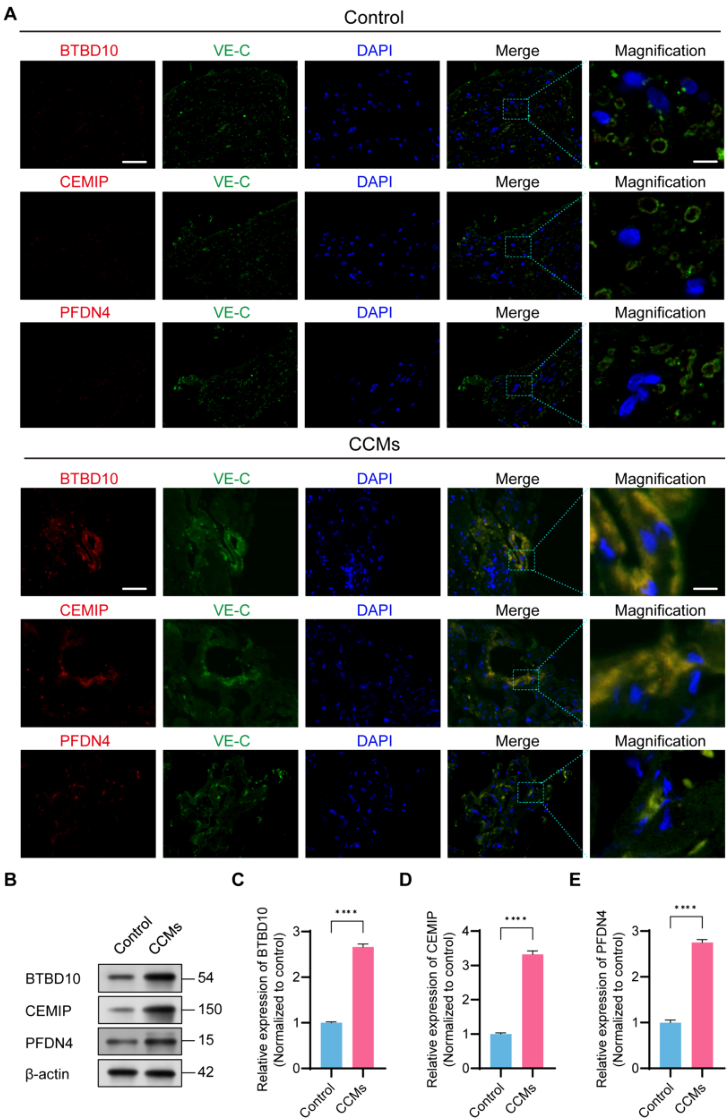
图8 hub基因的表达在HS-队列对照组和CCMs组之间进行验证。
8.枢纽基因在单细胞水平上的验证
本研究共获得4个样本(2个正常样本和2个CCMs样本)用于分析,它们来自scRNA-seq数据集(GSE155788)。其中,来源于正常组织的单细胞14623个,来源于CCMs的细胞15978个。将细胞分为红细胞、MΦ/MG、胶质细胞、内皮细胞和神经细胞五种主要细胞类型(图9A)。基于已知的标志物,选择内皮细胞细分细胞亚组,共鉴定出7个内皮细胞簇,包括动脉、动脉毛细血管、静脉毛细血管、静脉毛细血管(Mki67+)、静脉、尖端细胞和尖端细胞(Mki67+)(图9B)。通过分析发现对照组和CCMs组之间细胞分布的差异,随后的共表达分析显示,来自集群1的Btbd10和Pfdn4在CCMs的多个ECs中重叠(图9C),表明它们在细胞水平上具有高水平的共表达。来自集群2的Cemip在CCMs细胞群中的总体表达水平相对较低。进一步的亚组分析显示,与对照组相比,Btbd10和Pfdn4在尖端细胞(Mki67+)中高表达(图9D)。Btbd10在动脉中高表达,Pfdn4在静脉、静脉毛细血管(Mki67+)和动脉毛细血管中高表达。Cemip在静脉毛细血管(Mki67+)、尖端细胞和动脉毛细血管中高度表达,尤其是在静脉系统中。接下来,研究人员对CCMs不同细胞亚群中的枢纽基因与CRGs进行相关性分析,结果表明,这三种枢纽基因与CRGs之间存在异质性关系
(图9E)。前期研究发现Btbd10与多个细胞亚群中的多个CRGs显著相关,特别是在尖端细胞(Mki67+)中,它与三个基因Fdx1,Mtf1和Gls呈正相关。因此,Btbd10在ECs中的作用成为本研究后续探索的重点。接下来研究内皮细胞中Btbd10的表达升高是否与CCMs细胞间通讯的改变相一致。
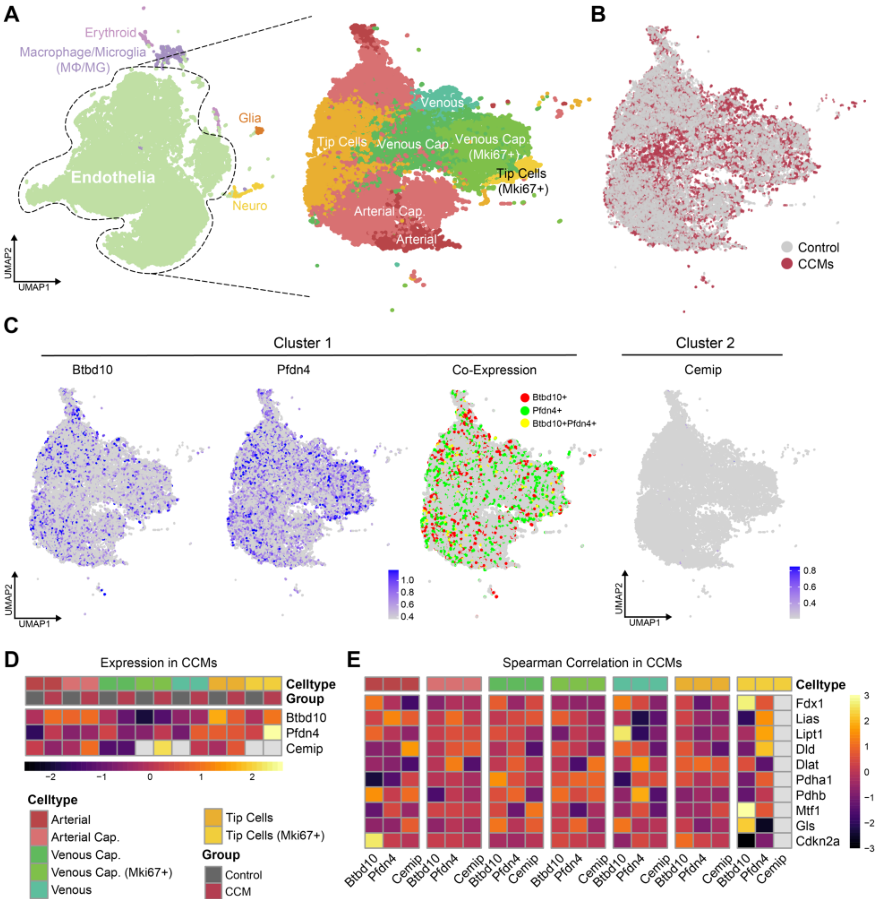
图9 scRNA-seq分析表明Mki67+尖端细胞是参与CCMs小鼠模型铜死亡的关键内皮亚簇。
CellChat工具分析结果显示,对照组和CCMs样品之间的细胞-细胞相互作用存在显著差异(图10A)。将MΦ/MG分为M1和M2两个亚簇以探索它们与高枢纽基因表达的内皮细胞CCMs样本的相互作用(图10B)。研究结果显示,M2 MΦ/MG与Btbd10+内皮细胞和Pfdn4+内皮细胞的相互作用强度比其他细胞强,表明这两个内皮亚簇可能在M2 MΦ/MG的相互作用中起主要作用。然而,M2 MΦ/MG与Cemip+内皮之间的相互作用比与整体内皮的相互作用弱,这表明Cemip+内皮与M2 MΦ/MG之间的相互作用可能不是主要的功能相互作用。进一步对细胞间配体途径进行深入分析,发现内皮细胞与高表达中枢基因和MΦ/MG之间的交流很可能主要通过多营养蛋白(Ptn)与核蛋白(Ncl)结合,以及纤维连接蛋白(Fn1)与整合素α 4 (Itga4)和整合素a1 (Itgb1)结合(图10C)。考虑到Bdbt10与几个内皮亚组的CRGs之间存在正相关,研究人员随后探索Btbd10+内皮与MΦ/MG之间显著的相互作用途径(图10D,左面板)。结果发现M2 MΦ/MG连接到Btbd10+内皮细胞的主要途径是通过Ptn-Ncl途径。相比之下,Btbd10+内皮细胞延伸到M2 MΦ/MG的连接主要通过Fn1-(Itga4+Itgb1)途径。此外,MΦ/MG和Btbd10+内皮细胞之间相应的信号通路受体和配体的表达增加(图10D,右面板)。
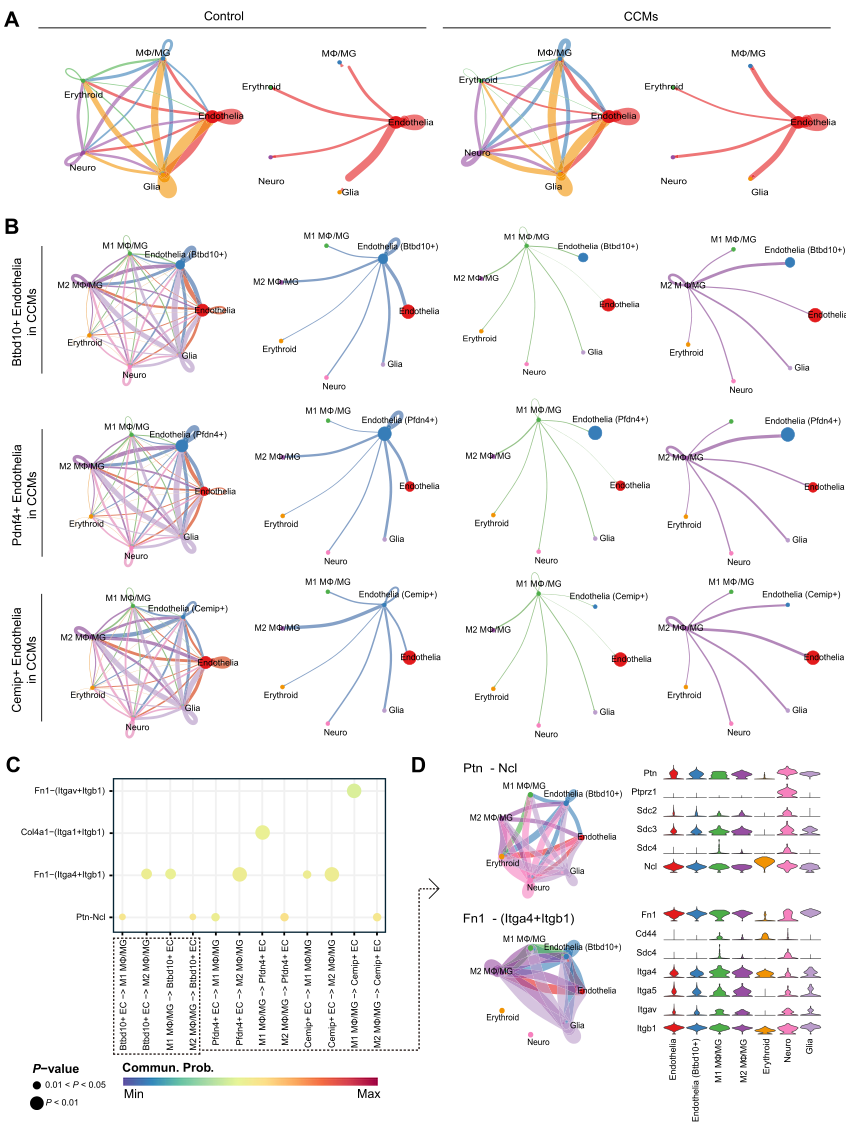
图10 在CCMs中,表达枢纽基因的内皮细胞亚簇与Mφ/MG之间的细胞间通讯动力学。
研究人员随后分析Btbd10与铜死亡的特征基因Fdx1之间的关系(图11A)。结果显示,Btbd10在CCMs样品的尖端细胞(Mki67+)中与Fdx1呈显著正相关,而在对照组中无显著相关。进一步的共定位结果也提示Btbd10和Fdx1在尖端细胞(Mki67+)群体中共表达(图11B)。这些结果表明,在细胞水平上,Btbd10与CCMs中的铜死亡之间存在实质性的相关。进一步从CCMs样品中分离出内皮中的尖端细胞(Mki67+),并通过Cellchat分析对其与其他细胞簇的相互作用进行评估。结果发现尖端细胞(Mki67+)与MΦ/MG,特别是M2 MΦ/MG具有显著的相互作用强度(图11C)。同时,与Btbd10低表达的尖端细胞(Mki67+)相比,Btbd10高表达的尖端细胞(Mki67+)与M2 MΦ/MG之间的相互作用强度显著增加(图11D)。最后,分析Bdbt10高表达或低表达的M2 MΦ/MG与尖端细胞(Mki67+)之间的配体-受体途径,发现它们主要通过Esam(内皮细胞选择性粘附分子)-Esam、Col4a1-(Itga1+Itgb1)(胶原IV型α 1链-(与整合素a1相互作用)+Itgb1)和Ptb-Ncl配体途径相互作用(图11E)。相反,M2 MΦ/MG与尖端细胞(Mki67+Btbd10-)之间的相互作用主要通过Col4a1-(Itga1+Itgb1)和Ptb-Ncl进行(图11F)。在M2 MΦ/MG与尖端细胞(Mki67+Btbd10+)的相互作用对中,相应途径中的配体和受体的表达增加。这些发现表明,M2 MΦ/ MG可能通过上述配体受体途径影响CCMs的进展,与尖端细胞(Mki67+)相互作用并驱动Mki67+的铜死亡,在这一过程中Btdb10可能在促进铜死亡促进中发挥作用。
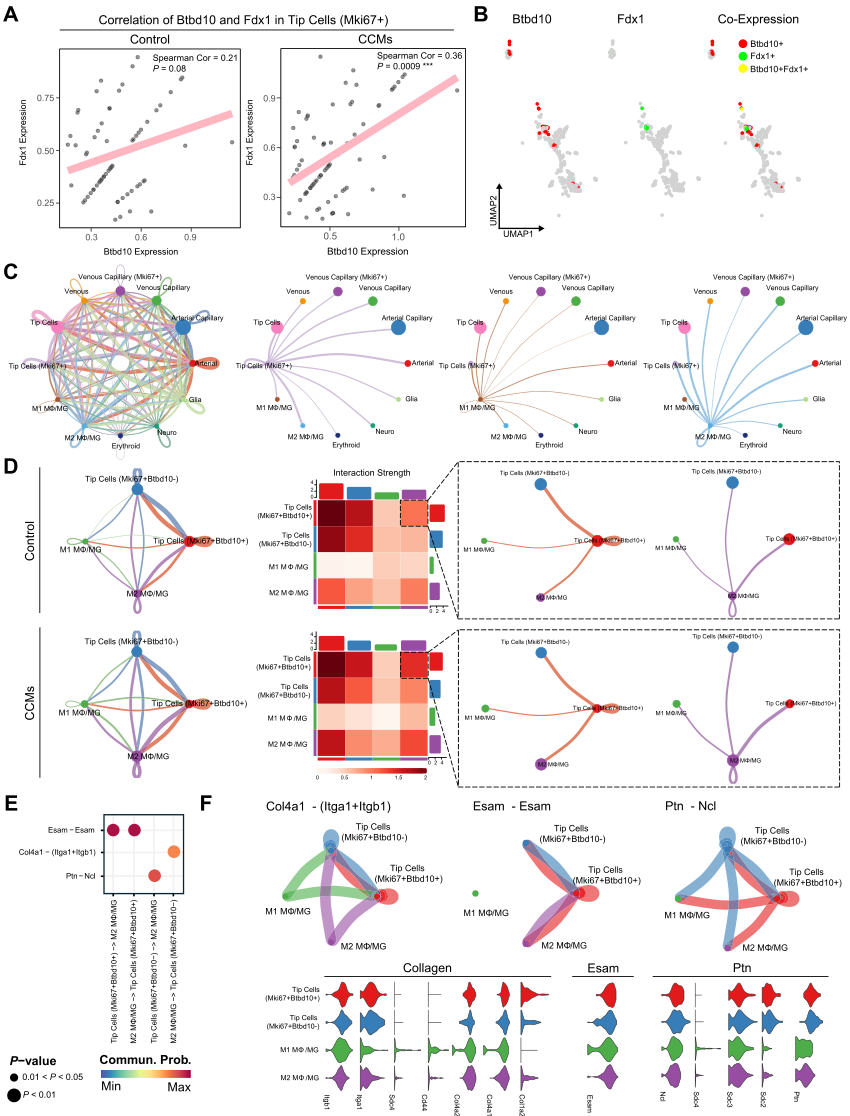
图11 Btbd10在Mki67+尖端细胞中的表达被认为可以增强CCMs中内皮-Mφ/MG的相互作用。
文章小结
本文采用单细胞RNA-seq测序技术,结合机器学习算法和细胞间通信分析,揭示两种不同的CCM亚型,并探索与铜死亡相关的基因(CRGs)的表达模式和免疫细胞浸润模式。研究发现三个与CCMs发病机制相关的枢纽基因:BTBD10、PFDN4和CEMIP,它们在CCM内皮细胞(ECs)中显著上调,可能通过调节免疫反应影响疾病的进展。此外,研究还揭示这些枢纽基因与免疫细胞之间的相互作用,特别是与M2型巨噬细胞的通信,这可能在CCMs的发病机制中起到关键作用。馆长认为,同学们可以借鉴作者团队在文中应用到的共识聚类分析、免疫细胞浸润分析、机器学习算法等方法的应用,这将帮助您的生信文章更上一层楼!如果您在生信选题、实验设计上还有进一步的需求,欢迎扫码关注馆长!馆长以及专业生信团队都准备好助你一臂之力!
馆长会持续为大家带来最新生信思路,也可以提供特色数据库构建、免费思路评估、付费生信分析和方案设计以及实验项目实施等服务,对数据库构建和生信分析感兴趣的朋友可以咨询馆长哦!