
撰文 | 我的闺蜜老红帽
CD4+T细胞是获得性免疫系统的核心成员。它们的主要功能是启动和调控免疫响应,从而应对外在病原体入侵和内在细胞癌变。CD4+T细胞同样在肿瘤免疫治疗方面起到至关重要的作用【1,2】,因为基于肿瘤新抗原的肿瘤疫苗作用依赖于CD4+T细胞响应【3-5】,肿瘤浸润淋巴细胞转输对肿瘤细胞转移的抑制作用也依赖于CD4+T细胞响应【6,7】。CD4+T细胞活化起始于对抗原表位的识别,而抗原递呈细胞表面所表达的MHC-II分子则行使递呈抗原功能。尽管这一过程在病原体感染、自身免疫病以及肿瘤中具有核心作用,但是MHC-II所递呈并被CD4+T细胞所识别的表位仍旧知之甚少,并且难以预测。这也是基础免疫学研究、肿瘤免疫治疗以及个性化肿瘤疫苗研发的瓶颈所在。
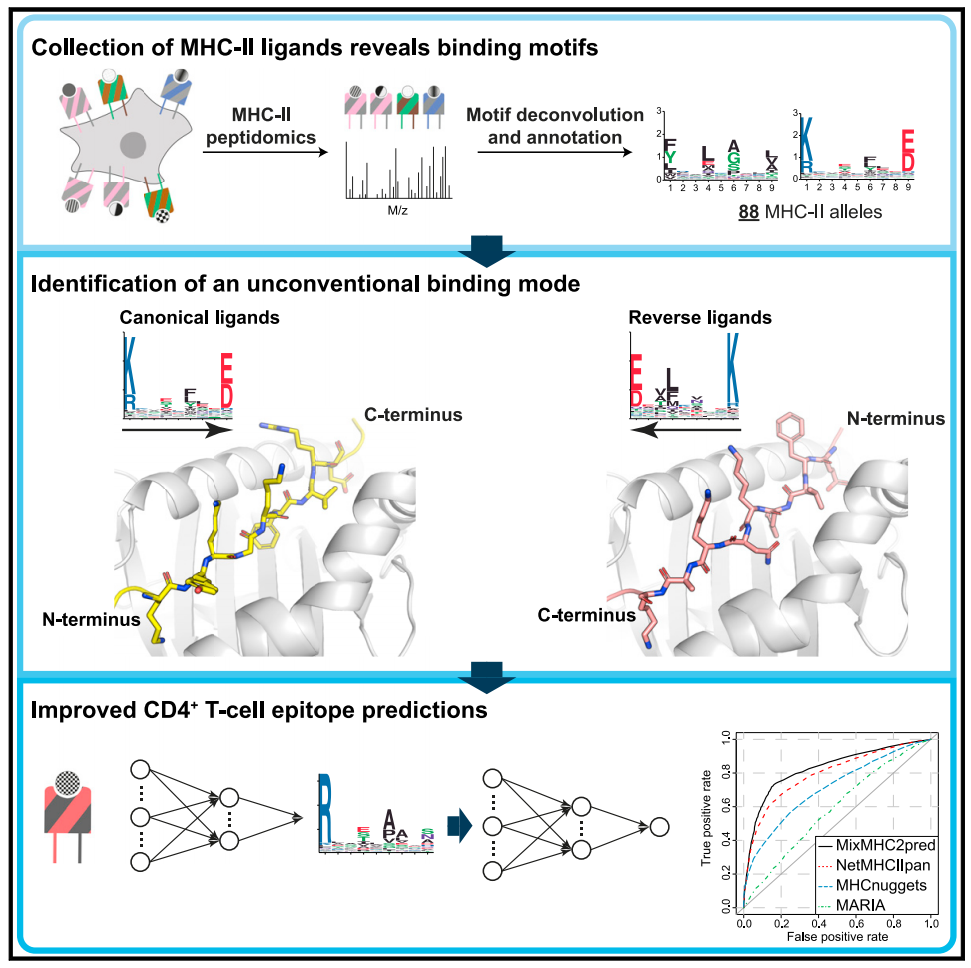
MHC-II所递呈的多肽需要经历抗原递呈通路处理,这些多肽绝大多数来源于通过内吞途径吸收和降解的胞外蛋白。经剪切后,这些通常有12-25个氨基酸的多肽,装配在MHC-II分子上,并展示到细胞表面。多肽在MHC-II分子上的装配需要分子伴侣激活,包括人类的HLA-DM和HLA-DO。MHC-II分子结合位点的结构已经经X-射线晶体成像解析出来,这也决定了MHC-II分子的配基需要含有一套高度保守的、相应的结合位点模式。这一模式主要含有两个部分:第一个是线性的九元结合核心,与MHC-II分子结合位点的大部分相互作用发生在这里;第二个是多肽边缘区域,可以延伸结合核心的N端和C端。在MHC-II配基结合核心的锚定位点存在特殊的口袋结构,主要位P1、P4、P6和P9。这类高度保守的结合模式也存在特例,比如对于鸡类来说,MHC-II分子配基的结合核心为十元。在人类中,已经报道有三组多肽可以以传统(从N端到C端)或者逆向(从C端到N端)方式相结合。当然,这类逆向结合模式出现的频率如何,以及与MHC-II分子配基和CD4+T细胞表位是否存在相关性仍旧不得而知。
近日,来自瑞士University of Lausanne的Alexandre Harari和David Gfeller研究组在Immunity上发表题为Machine learning predictions of MHC-II specificities reveal alternative binding mode of class II epitopes的文章,就上述问题进行了深入探讨。

人类的MHC-II也被称之为HLA-II,包含有三个可以直接给CD4+T细胞递呈抗原的等位基因,也就是HLA-DR (包括HLA- DRA1和 HLA-DRB1, -DRB3, -DRB4, 以及 -DRB5); HLA-DP (包括HLA-DPA1 和 HLA-DPB1); 和HLA-DQ (包括 HLA-DQA1和 HLA-DQB1 genes)。而MHC-II分子的多态性,其结合区域的高度多样性以及抗原递呈通路的复杂性,均是MHC-II配基以及CD4+T细胞表位难于预测的因素。作者团队以及其他研究组之前的工作展示了基于高通量质谱的MHC-II蛋白质组学分析来预测的可行性。
作者参考上述工作通过质谱识别,收集和确定了一套含有627,013个MHC-II分子配基的数据库,从而实现了跨越物种(人类-小鼠-牛-鸡)精准确定88个MHC-II等位基因的结合花样。通过与X射线晶体衍射深入分析这些结合特异性可以扩宽对MHC-II分子结构域的认知,以及揭示了一套HLA-DP配基的逆向结合模式。作者还开发了一套基于机器学习的研究平台,可以精准预测不同等位基因的MHC-II分子所对应配基,以及结合特异性。这个研究工具可以提升和扩展CD4+T细胞表位的预测精度和广度,也可以发现更多逆向结合模式的病毒和细菌表位。
综上所述,该工作确定了超过6000000组MHC-II配基,并且分离出88组MHC-II等位基因的高分辨率结构域。这些结构域呈现一类广泛存在的逆向结合模式。
原文链接:
https://doi.org/10.1016/j.immuni.2023.03.009
制版人:十一
1. Alspach, E., Lussier, D.M., Miceli, A.P., Kizhvatov, I., DuPage, M., Luoma, A.M., Meng, W., Lichti, C.F., Esaulova, E., Vomund, A.N., et al. (2019). MHC-II neoantigens shape tumour immunity and response to immuno- therapy. Nature 574, 696–701.2. Borst, J., Ahrends, T., Ba ̨ ba1a, N., Melief, C.J.M., and Kastenmu€ller, W. (2018). CD4+ T cell help in cancer immunology and immunotherapy. Nat. Rev. Immunol. 18, 635–647. https://doi.org/10.1038/s41577-018- 0044-0.3. Hu, Z., Leet, D.E., Allesøe, R.L., Oliveira, G., Li, S., Luoma, A.M., Liu, J., Forman, J., Huang, T., Iorgulescu, J.B., et al. (2021). Personal neoantigen vaccines induce persistent memory T cell responses and epitope spreading in patients with melanoma. Nat. Med. 27, 1–11.4. Ott, P.A., Hu, Z., Keskin, D.B., Shukla, S.A., Sun, J., Bozym, D.J., Zhang, W., Luoma, A., Giobbie-Hurder, A., Peter, L., et al. (2017). An immunogenic personal neoantigen vaccine for patients with melanoma. Nature 547, 217–221. https://doi.org/10.1038/nature22991.5. Sahin, U., Derhovanessian, E., Miller, M., Kloke, B.-P., Simon, P., Lo ̈ wer, M., Bukur, V., Tadmor, A.D., Luxemburger, U., Schro ̈ rs, B., et al. (2017). Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. Nature 547, 222–226.6. Tran, E., Turcotte, S., Gros, A., Robbins, P.F., Lu, Y.-C., Dudley, M.E., Wunderlich, J.R., Somerville, R.P., Hogan, K., Hinrichs, C.S., et al. (2014). Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science 344, 641–645. https://doi.org/ 10.1126/science.1251102.7. Zacharakis, N., Chinnasamy, H., Black, M., Xu, H., Lu, Y.-C., Zheng, Z., Pasetto, A., Langhan, M., Shelton, T., Prickett, T., et al. (2018). Immune recognition of somatic mutations leading to complete durable regression in metastatic breast cancer. Nat. Med. 24, 724–730.
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。
