靶向PD-1/PD-L1的免疫检查点抑制剂的开发极大改善了肿瘤患者的预后和生存率。但是,PD-1/PD-L1单抗仍存在有效率较低和获得性耐药等问题。因此克服PD-1/PD-L1治疗的局限性或者开发新的用于治疗肿瘤的免疫检查点显得极为重要。TIGIT是目前被认为最具有潜力的靶点之一,但TGIT抑制剂现有的表现并不尽如人意,TGIT抑制剂的路在何方?【肿瘤资讯】特别邀请到诸暨市人民医院何相峰教授,进行详尽的盘点和解读。
诸暨市人民医院胸外科副主任
中国研究型医院协会胸外科专业委员会委员
中国医药教育协会胸外科专业委员会委员
浙江省创伤学会胸外科专业学组委员
浙江省医师协会胸外科分会微创学组委员
绍兴市抗癌协会肺癌专委会副主任委员
绍兴市医学会微创外科专业委员会委员
人类对抗癌症已经进入了免疫治疗时代,免疫治疗已经成为肿瘤治疗一种新的治疗模式,在多种类型肿瘤治疗中获得显著的疗效,但仍有大量患者并没有从中获益,这些患者往往具有肿瘤突变负荷低、新抗原负荷低、肿瘤微环境免疫抑制等特征。研究人员认为肿瘤可能存在其他未知免疫抑制途径。

PD-1/PD-L1抑制剂已经贯穿肺癌治疗全程,从围手术期到一线、二线。对于既往接受过免疫治疗的患者发生耐药后,如何逆转耐药,是很多专家比较关心的点。免疫治疗耐药的解决策略其中一条是:新靶点的探索。
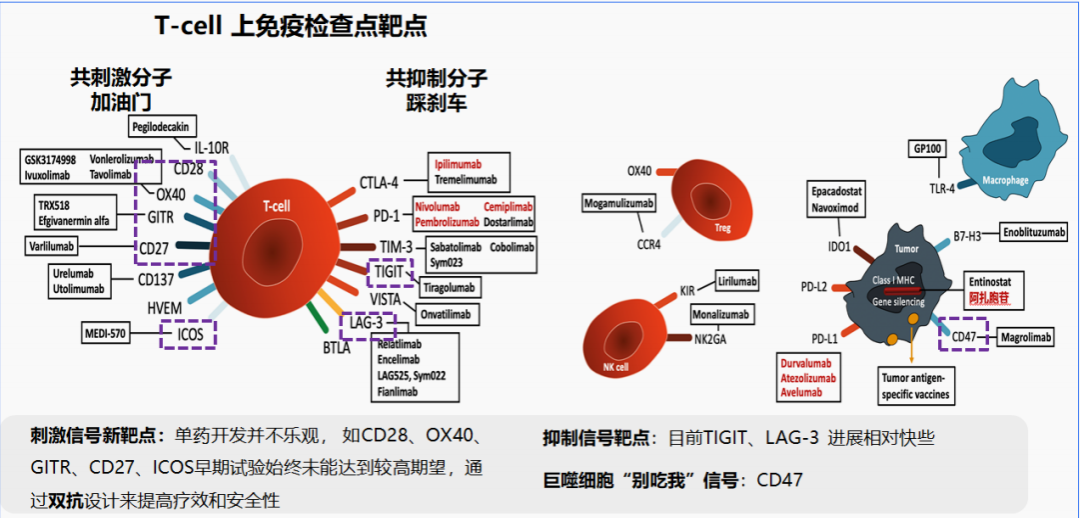
TIGIT是一种新的免疫抑制分子,在多种肿瘤中可发现其表达异常,多个研究表明TIGIT能够导致免疫细胞功能障碍,与肿瘤进展、预后不良相关,通过阻断 TIGIT可以逆转免疫细胞功能衰竭,发挥抗肿瘤效应,有望成为新一代免疫治疗靶点。然而,今年的抗肿瘤征途中,TIGIT抗体出师不利。那么TIGIT抑制剂路在何方,能否逆风翻盘?
英文名称:T cell immunoglobulin and ITIM domains
中文名称:T细胞免疫球蛋白ITIM结构域
上市药物数量:0
临床药物数量:26
靶点别称:VSTM3,VSIG9,WUCAM,TIGIT
最高研发阶段:临床三期
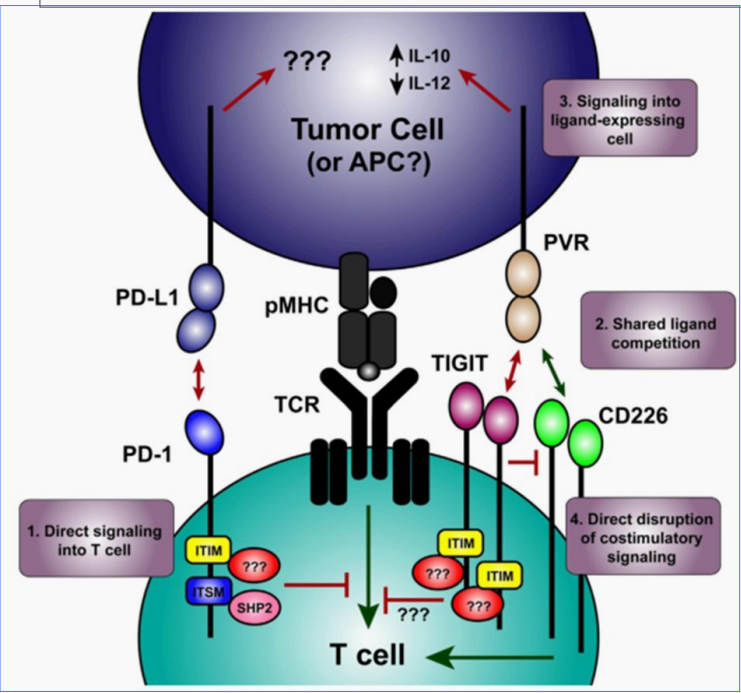
① 表达在人NK细胞上的TIGIT能够通过与PVR和PVRL2的相互作用抑制NK细胞的细胞毒作用,且这一调节作用是直接通过TIGIT的胞内ITIM基序调节 其下游信号通路实现,与T细胞表面的TIGIT发挥功能的方式不同。
② TIGIT在肿瘤浸润T细胞表面高表达,使用抗体同时阻断TIGIT和PD-1能够特异性地增强CD8+T细胞的抗肿瘤效果,而阻断CD226则会抵消阻断TIGIT产生的激活效果。

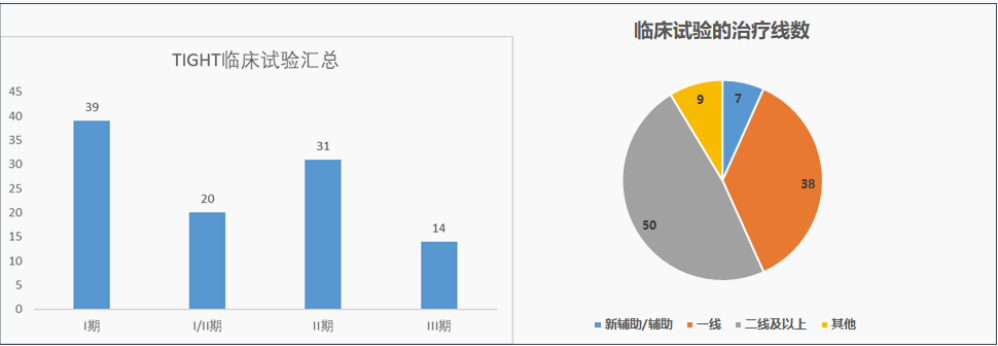
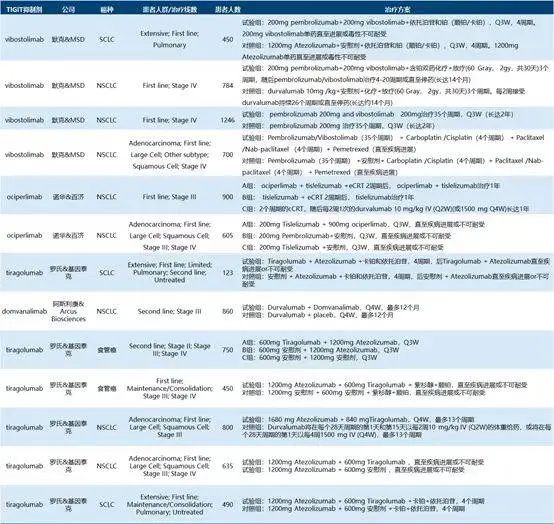
截止到2022年3月,在citeline 数据库中查找包含“TIGIT”靶点的药物的临床试验,共查到104个,目前开展的临床试验包含“lung”or 包含“solid tumor”的临床试验占比61%(63/104),已经进入临床试验的TIGIT检查点抑制剂共查到26个。
绝大多数研究I-II期87%(90/104),二线及以上治疗线数的占比48%(50/104),包含PD-1/PD-L1抑制剂联合TIGHT抑制剂的研究占比56%(58/104)。
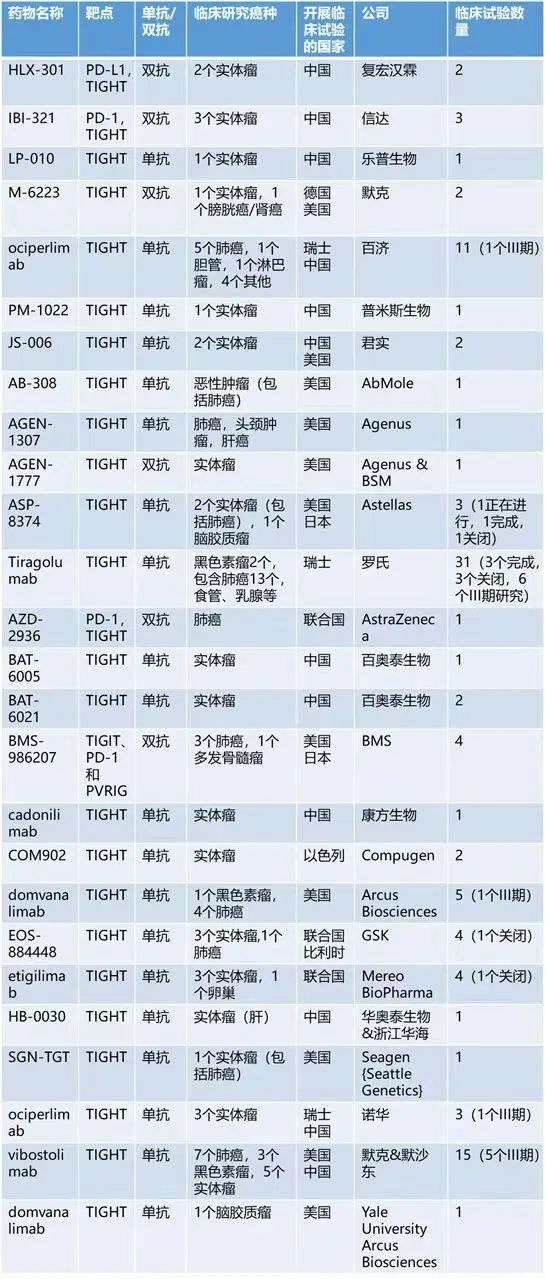
① vibostolimab(维博利单抗,一种抗TIGIT单抗)单药或联合帕博利珠单抗治疗晚期实体瘤(包括肺癌)的首个I期研究 一项I期、全球、双盲、随机试验NCT02964013,研究评估vibostolimab 单药或联合帕博利珠单抗治疗晚期实体瘤的安全性。
A组的患者每3周接受递增剂量的vibostolimab单药治疗(第1组)或vibostolimab + 帕博利珠单抗 200mg (Q3W);因PD而停止vibostolimab单 药治疗的患者有资格交叉接受联合治疗。Vibostolimab药物探索6个 预定剂量水平,每3周(Q3W)给药2.1 mg,7 mg,21 mg,70 mg,210 mg和700 mg。
B部分纳入的患者接受vibostolimab 200mg Q3W单药治疗或帕博利珠单抗200mg Q3W治疗。
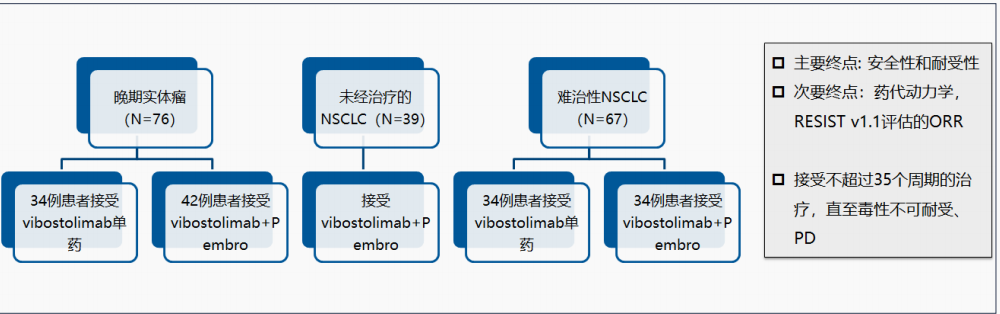
② 2020 ESMO大会公布Vibostolimab (维博利单抗,一种抗TIGIT单抗)的I期临床试验结果,NCT02964013,没有看到满意的疗效。
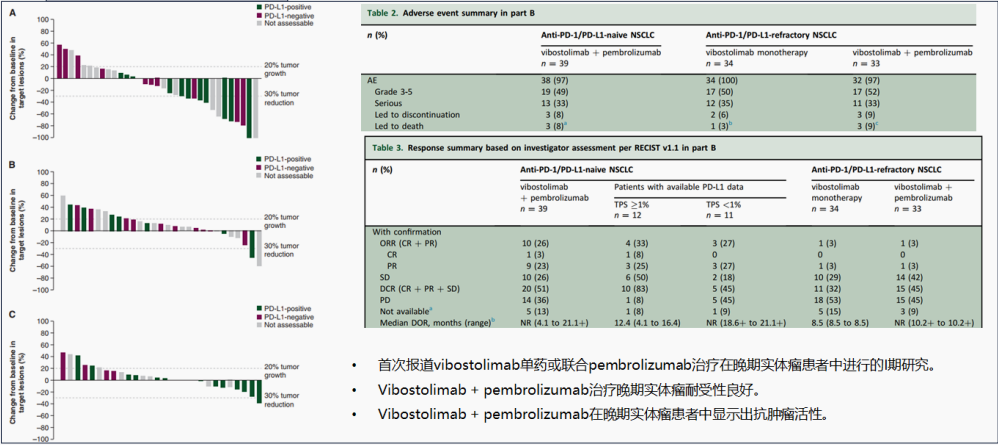
该研究纳入了79例既往接受过PD-1/PD-L1单抗的难治性NSCLC患者,其中41 例患者接受Vibostolimab单药治疗,38例接受Vibostolimab联合帕博利珠单抗。Vibostolimab单药或联合PD-1组的ORR分别为7%和5%。从短期结果上来看,该方案对于既往接受过免疫治疗的患者并未显著获益。
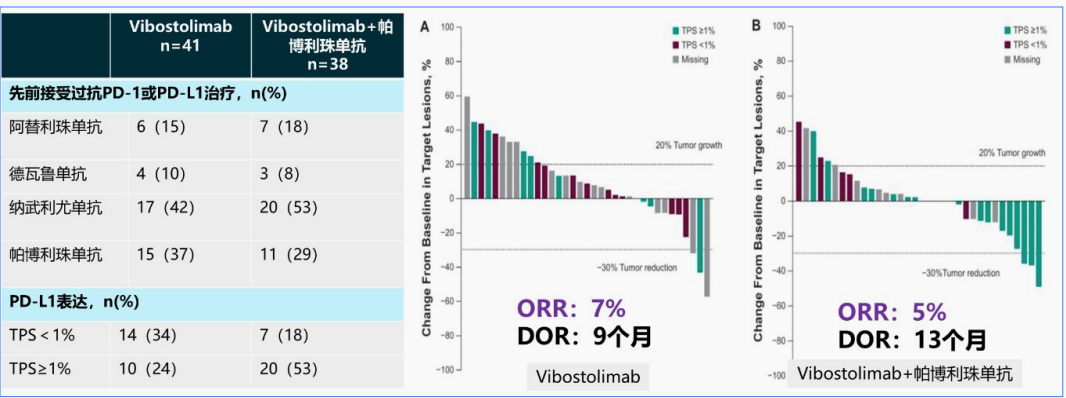
单药疗效低,决定了TIGIT抗体临床突破点只能是寻求合适的协同用药以增强免疫治疗的效果。TIGIT抗体和LAG-3抗体这类药物定位就是为免疫治疗的增敏剂。
TIGIT抑制剂联合PD-1/L1抑制剂组合用药,是否能找到出路?
① 2020年AACR大会公布了Tiragolumab (替瑞利尤单抗,一种TIGIT全人源化单克隆抗体)的I期临床试验结果。在13例使用Tiragolumab +阿替利珠单抗治疗扩展期非小细胞肺癌患者中,ORR(客观缓解率)为46%,DCR(疾病控制率)为85%。在试验剂量扩大阶段所研究的剂量水平上,没有发现剂量限制毒性。当给予Tiragolumab作为单药治疗时,没有观察到客观的反应,但一些患者有肿瘤缩小。
② 2020年ASMO大会公布CITYSCAPE研究结果,Tiragolumab(替瑞利尤单抗,一种TIGIT全人源化单克隆抗体)+阿替利珠单抗 vs 安慰剂+阿替利珠单抗:一线治疗PD-L1阳性驱动基因阴性的IV期NSCLC,一项随机双盲II期临床试 验。
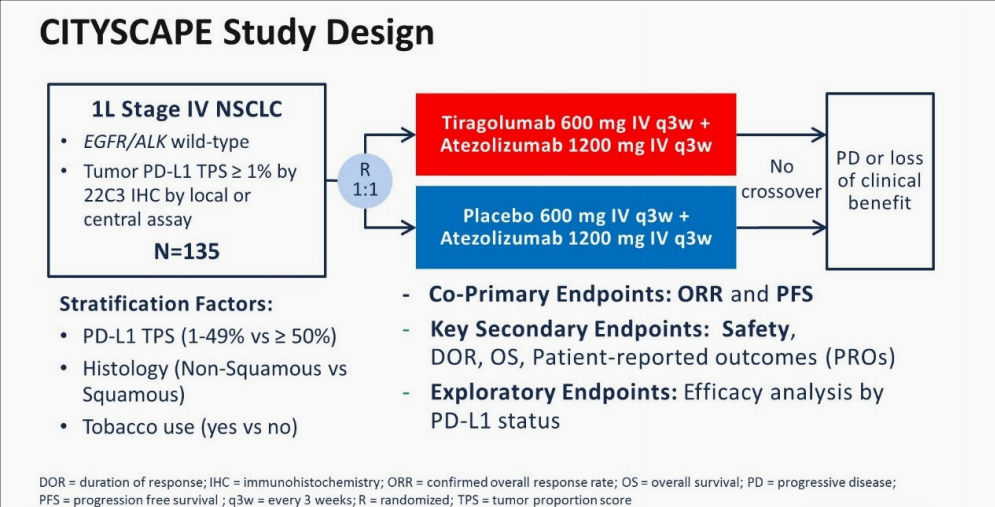
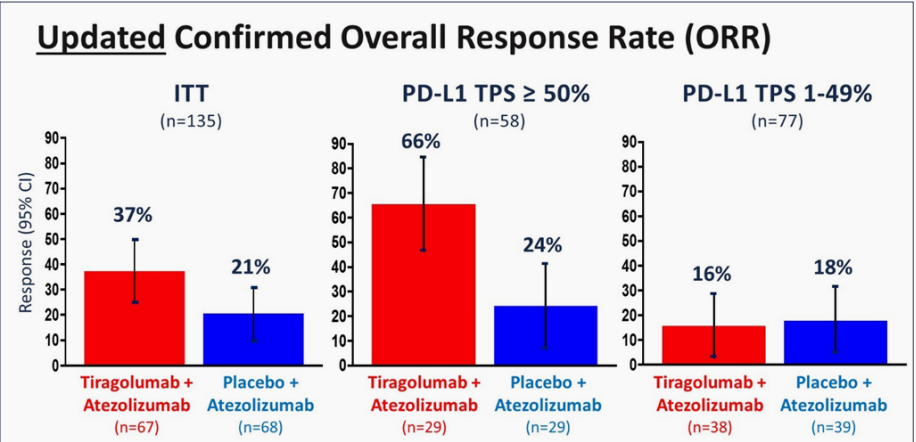
该研究纳入了135例EGFR/ALK阴性,PD-L1 TPS≥1%,IV期的NSCLC患者,随机1:1进行Tiragolumab+阿替利珠单抗 vs 安慰剂+阿替利珠单抗治疗,直到疾病进展或毒性不可耐受,38例接受Vibostolimab联合帕博利珠单抗。患者按PD-L1表达1%-49%和≥50%、鳞癌和非鳞癌、有无吸烟史进行分层。主要终点是客观缓解率(ORR)和PFS。
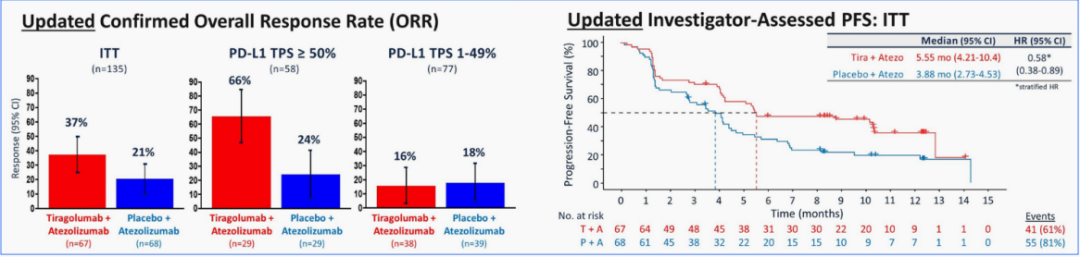
在ITT人群中:
■ ORR(联合组vs 单药组):37%vs 21%
■ mPFS (联合组vs 单药组):5.55个月vs 3.88个月,疾病进展风险下降42%;
特别是在PD-L1 TPS>50%的患者群体中:
■ 相比于单药组,联合组的ORR提升更加明显(66% vs 24%),联用效果更好。
安全性方面,安慰剂+阿替利珠单抗组和Tiragolumab+阿替利珠单抗组的TRAEs(治疗相关不良事件)发生率分别为72%和80.6%,其中≥3级TRAEs分别占19.1%和 14.9%,导致停药的AEs分别为10.3%和7.5%。这说明,药物的联用并未带来额外的不良反应事件,安全性可控。
Tiragolumab+阿替利珠单抗一线治疗TPS≥1%NSCLC相比单药提升,但是与“纳武利尤+伊匹单抗” 、“阿替利珠单抗+贝伐珠单抗”相比的疗效是否有提升,这个问题值得我们思考。
■ 参考IMpower110 (TC1/2/3 or IC1/2/3)、KEYNOTE-042(TPS ≥1%),PD-1/L1单药ORR (27%-31.4%)、mDOR(22.3-26.3)、mPFS(5.4-5.8);
■ 参考Nivo+IPI:CheckMate 277 (TPS ≥1%)亚组分析, ORR 35.9%,中位PFS 5.1月;
■ TIGIT+Atezo的方案相比Atezo联合贝伐珠单抗、Nivo+IPI是否更优?需要临床试验的验证。
CITYSCAPE研究中PD-L1高表达(TPS≥50%)的人群进行亚组分析,共58例患者,DOR和OS 尚未成熟,仅对PFS数据进行报道。
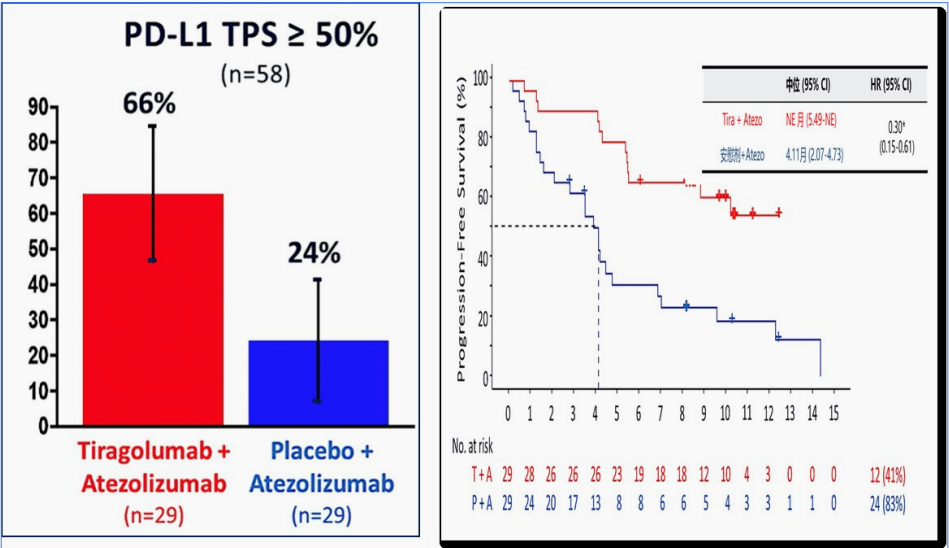
■阿替利珠单抗+Tiragolumab一线治疗PD-L1 TPS≥50%的NSCLC, 相比阿替利珠单抗明显提升ORR (66% vs24%)和PFS( NE vs 4.11个月,HR =0.3)。
■ 参考KEYNOTE-024、IMpower110、EMPOWER-Lung1、KENOTE-042数据,PD-L1TPS≥50% 高表达人群一线治疗免疫单药疗效:ORR(39%-46.1%);DCR (66%-70.1%);mDOR( 16.7-29.1);mPFS (7.1-10.3);mOS (20.0- 26.3)。
■ 阿替利珠单抗+Tiragolumab(TIGIT抗体)一线治疗TPS≥50%NSCLC,相比PD-1/L1单药表现出令人鼓舞的疗效,基于此数据开展了III期临床试验,NCT04294810 。
■ 参考阿替利珠单抗+贝伐珠单抗II期研究: ORR 64.1%,mPFS达15.9月;Nivo+IPI:CheckMate 277亚组分析ORR 44.4%,中位PFS 6.7月。相比于阿替利珠单抗+贝伐是否更优?需要更多的临床试验验证。
Tiragolumab联合阿替利珠单抗一线治疗PD-L1 TPS 1-49% NSCLC疗效不理想(N=77)。
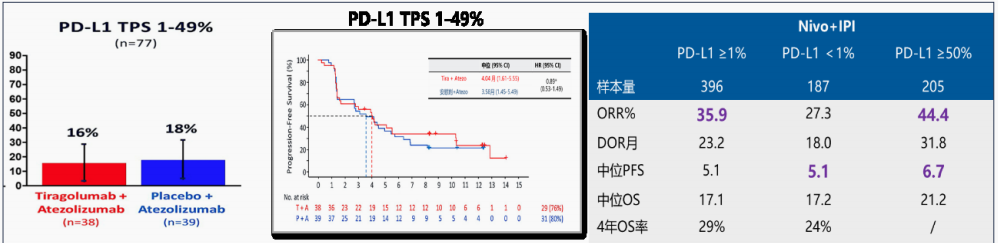
■ 相比阿替利珠单抗 :在PD-L1 TPS 1-49% 人群并未提高ORR和PFS;分别16%vs 18% , 4.04 vs 3.58 月。
■ 相比Nivo+IPI: 在TPS 1-49% 人群ORR 和PFS 也没有看到优势 在TPS 1-49% 人群Tiragolumab+Atezo 可能不如免疫联合化疗方案或者Nivo+IPI方案。
引申思考:
TIGIT 单抗联合阿替利珠单抗:在PD-L1 高表达人群相比阿替利珠单抗显著提升ORR和PFS,但在PD-L1 1-49% 人群为何连阿替利珠单抗单药都并没有优势?
TIGIT单抗与LAG3 单抗相比,哪个更适合联合PD-(L)1?
新双免的组合(TIGIT+PD-L1)相比Nivo+IPI 的双免组合,是否有优势?
③ 2022年公布了一项III期临床试验SKYSCRAPER-02的研究结果:Tiragolumab+阿替利珠单抗一线治疗未经治疗的广泛期小细胞肺癌三期临床试验中未成功,Tiragolumab+阿替利珠单抗+化疗 vs 阿替利珠单抗+化疗,在PFS和OS终点并未有显著差异。
这也是全球首个TIGIT抑制剂失败的III期研究。为TIGIT的竞争赛道蒙上了一层阴影。Derek Lowe也对此做了评论,提到也许TIGIT作为肿瘤靶点并不是那么有用,如果我们能把所有的东西都完美地排列起来,那么它绝对是有临床意义的。这并不是人们真正想要的。而且提到了一个更大的担忧:也许在整个免疫-肿瘤学领域没有那么多协同的机会。要更应该选择那些本来就显现出药物疗效的靶点,而不是单纯考虑协同作用。
④ SKYSCRAPER-01研究(NCT04294810):Tirago联合阿替利珠单抗与安慰剂联合阿替利珠单抗治疗既往未治疗的局部晚期不可切除或转移PD-L1选择非小细胞肺癌的比较研究。
相比单独使用阿替利珠单抗组的患者,Tirago联合阿替利珠单抗未能延长联合组患者的PFS,OS数据仍在等待中。
⑤2021年WCLC大会上公布了ARC-10 (NCT04736173)研究设计方案,一项III期、随机、多中心、开放标签研究,旨在评估在EGFR/ALK野生型、 PD-L1高表达、III-IV期的NSCLC患者中,A组(含铂双药化疗)vs B组(zimberelimab单药)vs C组(zimberelimab + domvanalim)的一线治疗的疗效。
■ 主要研究终点为:A组与B组的OS数据,B组与C组的OS及PFS数据。
■ Zimberelimab:一种靶向PD-1的人源性IgG4 mAb
■ Domvanalimab:一种靶向TIGIT的人源化IgG1 mAb

⑥ 其他III期临床试验
■ Skyler-01研究:正在评估该组合与安慰剂+阿替利珠单抗对先前未经治疗、局部进展、不可切除或转移、PD-L1阳性的NSCLC的疗效。
■ SKYSCRAPER-07研究(NCT04543617):阿替利珠单抗加或不加Tirago治疗不可切除的局部晚期食管鳞状细胞癌的研究。
■SKYSCRAPER-06研究(NCT04619797):Tirago联合阿替利珠单抗+培美曲塞和卡铂/顺铂与帕博利珠单抗+培美曲塞和卡铂/顺铂在既往未治疗的晚期非鳞状非小细胞肺癌患者中的对比研究。
■SKYSCRAPER-03研究(NCT04513925):Atezo和Tirago与Durva治疗局部晚期、不可切除的III期非小细胞肺癌(NSCLC)的研究。
⑦ 其他的研究进展
■ IBI939是信达生物研发的国内首个TIGIT抗体,用于治疗晚期肿瘤(血液肿瘤和实体瘤)。TIGIT是一款免疫检查点抑制剂,主要在T细胞和NK细胞表面表达,在它们的激活和成熟过程中起重要作用。TIGIT在肿瘤免疫抑制中的作用和PD-1/PD-L1 类似。多项临床前试验结果表明 anti-TIGIT 抗体和anti-PD-1/PD-L1 抗体可发挥协同抗肿瘤作用。
■ IBI321是信达生物制药与礼来制药合作研发的抗PD-1/TIGIT双特异性抗体,于今年5月获批临床,适应症为晚期恶性肿瘤。IBI321临床前的各项研究结果均显示,IBI321保留了PD-1抑制剂的药效活性,并同时抑制TIGIT的信号,协同增强药效。2021年,IBI321的I期临床研究(CIBI321A101)完成中国首例患者给药,该研究的主要目的为评估IBI321双特异性抗体在标准治疗失败的晚期恶性实体瘤受试者中的安全性、耐受性和抗肿瘤活性。
■ 2021年11月,PM1022(TIGIT抑制剂)的临床试验申请获得NMPA受理,为国内首款PD-L1/TIGIT双抗。PM1022可通过同时结合TIGIT和 PD-L1阻断TIGIT/CD155(CD112)和PD-L1/PD-1免疫抑制通路,促进免 疫细胞对肿瘤细胞的杀伤。在体内药效试验中表现出明显优于TIGIT单 抗、PD-L1单抗和PD-1单抗,且非劣于TIGIT单抗+PD-L1单抗联合用药 的抗肿瘤作用。
其他正在进行的III期临床试验
PD-L1表达水平是TIGIT合适的生物标志物吗?
在一项II期CITYSCAPE研究中,我们看到PD-L1高表达(TPS≥50%)的患者中最明显,联合用药(T+A)的ORR为69%,对照组为24.1%。然而,在PD-L1TPS表达为1%-49%的患者中,试验组与对照组之间的疗效相似,分别为16%和18%,并未达到显著差异。
根据2期CITYSCAPE临床试验的结果,3期SKYSCRAPER-01研究将肿瘤组织PD-L1高表达作为入组标准,但是PFS并未取得阳性结果,提示PD-L1蛋白也许并不是TIGIT抗体的优选biomarker。
而另外一项III期随机对照临床试验ARC-10研究,在研究设计中,同样也将肿瘤组织PD-L1高表达作为入组标准,该研究的结果暂未报道。
TIGIT抗体定位为免疫治疗增敏剂,对于PD-L1高表达或者无表达的患者更具意义,这个结果已经提示我们需要思考,对于TIGIT抗体临床试验的肿瘤生物标志物选择,肿瘤组织PD-L1表达水平能否撑起一片天?
研究者对TCGA和GTEx等数据库的33种癌症分析,研究表明TIGIT在癌症患者中的表达与癌症的分期、肿瘤浸润免疫细胞、效应T细胞、耗竭性T细胞、 CTLA4、PD-1、PD-L1、ICOS、肿瘤突变负荷、微卫星不稳定性、DNA错配修 复、DNA甲基转移酶等多种因素相关。TIGIT轴本身组成和机制的复杂性提示 了,该抗体的临床试验的biomarker可能是多分子。
CD226广泛表达于免疫细胞,包括T细胞、NK细胞和单核细胞,CD226是一种跨膜糖蛋白,由两个免疫球蛋白v样结构域(D1和D2):一个I型跨膜结构域和一个胞内结构域组成。
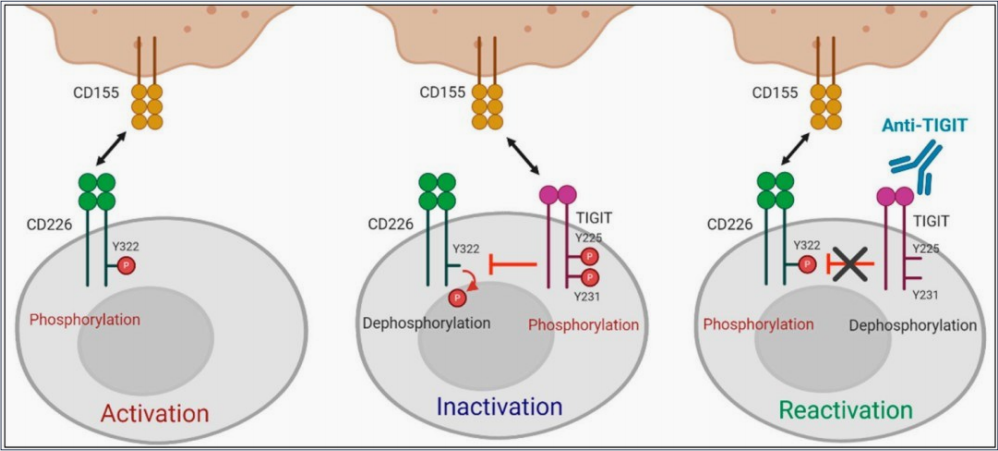
CD226信号通路在NK细胞中已被广泛研究。CD226通过相应的配体结合后,定位于脂筏,并通过与SAP97、MAGUK和肌动蛋白结合蛋白4.1G的结合,与肌动蛋白细胞骨架结合。在免疫突触的形成过程中,CD226传递一个激活信号,随后诱导LFA-1的聚 集。蛋白激酶C(PKC)磷酸化CD226的S326残基,诱导LFA-1与CD226相连。LFA-1与ICAM-1结合,促进其构象变化,导致Fyn的募集,从而磷酸化CD226 的Y319残基。Y319位点的磷酸化触发了NK细胞中ERK和AKT的激活,对NK 细胞的细胞毒性至关重要。
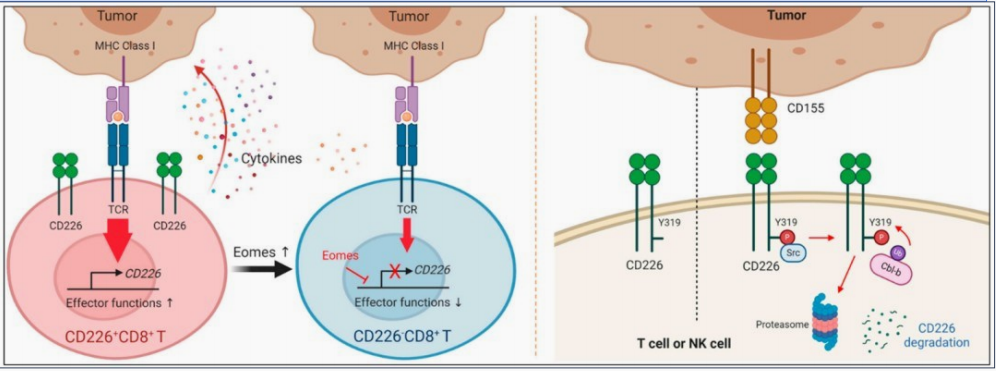
CD226敲除的荷瘤小鼠模型,PD-1和TIGIT抗体药物作用受限,提示CD226为二者作用所必需。使用CD226中和单克隆抗体(mAb)可以消除PD-1抗体和 TIGIT抗体联合治疗的疗效。
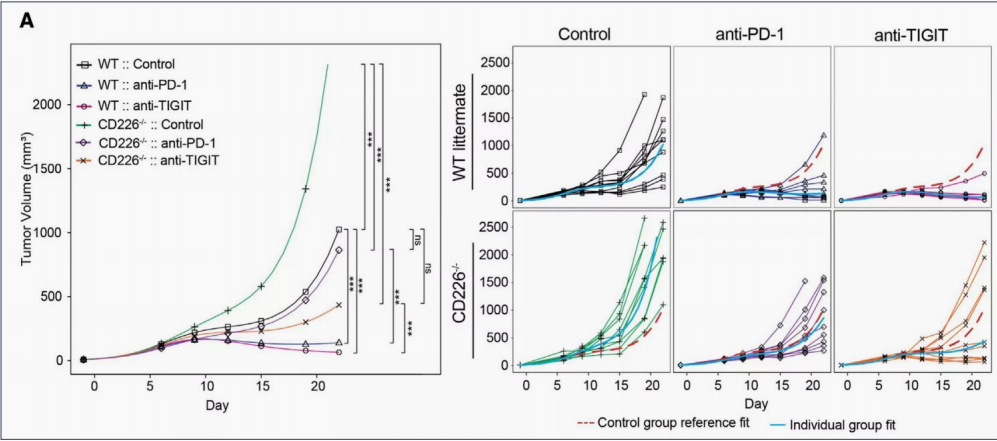
所以通过进一步临床试验,分析CD226的价值。
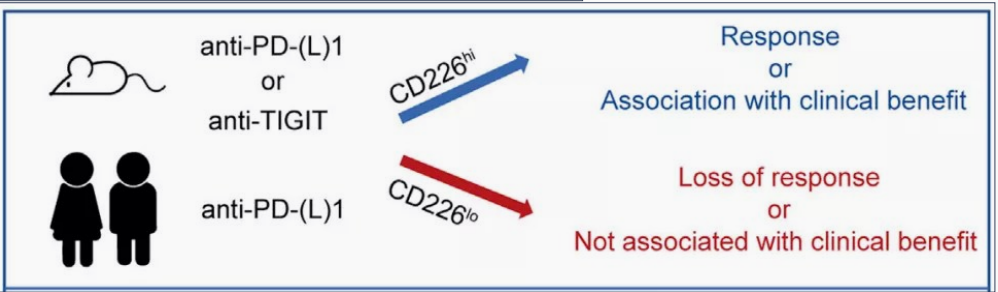
Genentech在最近Immunity发文分析了阿替利珠单抗的三个临床研究(BIRCH、OAK、POPLAR)中,CD226在临床评估中的价值。与CD28、PDCD1、TIGIT相比,CD226的表达与临床良好预后相关性更好(P <0.001)。
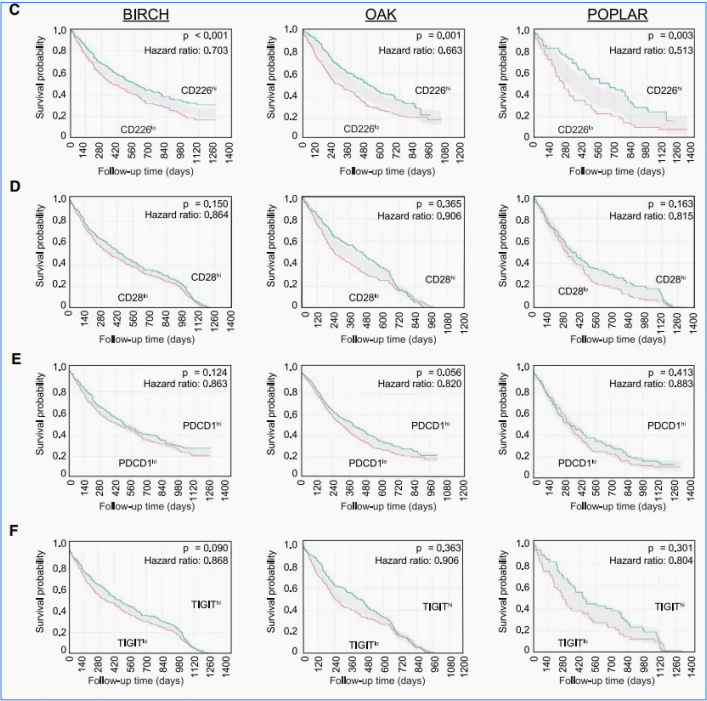
综上所述,CD226对于免疫检查点起着重要作用,可以作为疗效的预测biomarker,当然需要更多的数据支持和验证。
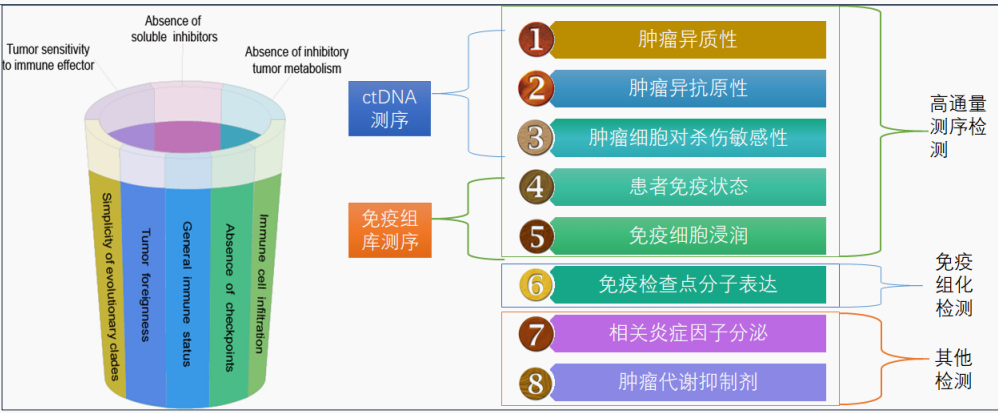
影响免疫检查点抑制剂的疗效因素是众多的,根据2016年发表在Science杂志上的两篇文章,可以概括出,影响肿瘤免疫的八大因素:肿瘤异质性、肿瘤异抗原性,肿瘤细胞对杀伤敏感性,患者免疫状态,免疫细胞浸润,免疫检查点分子表达,相关炎症因子分泌,肿瘤代谢抑制剂等。
此外,肠道菌群与免疫治疗的研究报道也颇多。
■ 临床缓解的患者体内的微生物更具多样性,拥有更多的特定细菌。
■ 在Science杂志上,两项对老鼠的研究表明,肠道微生物群落——肠道内成群的微生物——决定了这些癌症免疫疗法的有效性。益生菌可能通过激激活T细胞促进药物发挥作用。为了进一步探讨肠道菌群失调对ICI 的影响研究者分析了使用PD-1抑制剂治疗前后,患者的一系列粪便样本中肠道细菌种类的定量元组学。
■ Routy等人报道了与疾病相关或抗生素诱导的肠道微生物紊乱与PD-1阻断不良的临床反应相关。
■ 单独口服双歧杆菌以及单独使用PD-1抑制剂治疗在一定程度上改善了肿瘤的控制,联合治疗几乎消除了肿瘤的生长。在接受了来自缓解患者的粪便移植的小鼠体内的肿瘤和肠道中这些益生菌更为丰富。
调控微生物组也是一个思路
■ 2018年Science杂志上发表了一篇文章,研究表明抗生素在晚期癌症患者中可能抑制免疫检查点抑制剂的疗效,有试验表明对免疫检查点抑制 剂的反应和革兰氏阴性共生菌Akkermansia muciniphila 的水平相关。
■ 因此,有选择性地对肠道微生物种群成分的调节可能帮助克服对免疫检查点抑制剂的抗性。
■ “好”细菌的数量增多与在血液循环中CD4+和CD8+ T细胞的数量增多相关,在黑色素瘤患者中,它们与对抗PD-1疗法的响应也相关。
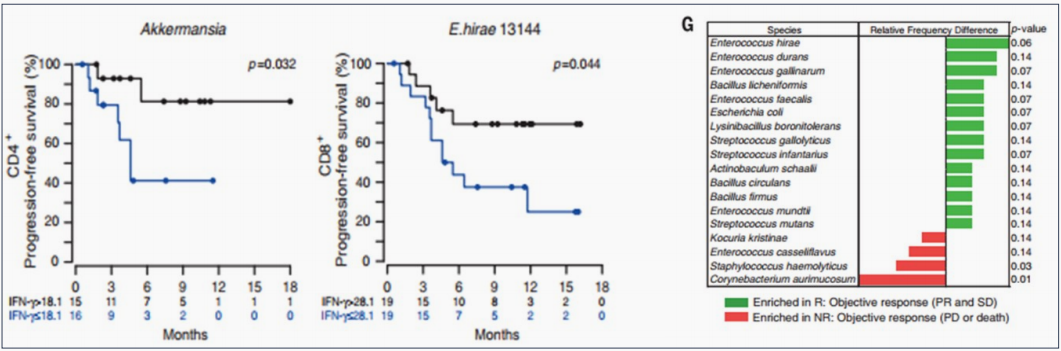
■ 从机制上来看,TIGIT已经被证明在T细胞和NK细胞的活性调节中都起到重要的作用,因此阻断该免疫检查点可能影响的不止T细胞,还有NK细 胞,这是与其他类似的热门靶点的差异之处。
■ 目前,已经进入临床试验的TIGHT检查点抑制剂共查到26个,在开展的临床试验中,61%的比例与肺癌相关。
■ 从以上这些在研的TIGIT抑制剂的临床试验情况来看,TIGIT抑制剂单药并不是一个好的选择,而组合用药的策略,大多是TIGIT抑制剂联合PD- 1/PD-L1方案,I期II期研究数据可期。
■ 但是III期研究结果的公布,似乎出乎意料。也许明明之中能找到答案,关于免疫检查点抑制剂的临床试验不成功有很多可能性,比如:机理不 对,临床研究设计不当,联合用药的方案不合适,患者人群选择不当,统 计学设计不当,抗体药物结构等原因,也许仅是运气不佳。
■ TIGIT是否完全摒弃?个人感觉还有成功的可能性,我们根据目前的数据推测,是否能从抗体结构改造、重新分析研究TIGIT的作用机制,选择更合 适的入组人群,选择合适的biomarker,选择其他联合用药的方案等方面入手?
■ TIGIT抗体定位为增敏剂,免疫联合用药可以探索更多的联合治疗方式。比如:联合抗血管抑制剂改善肿瘤微环境,联合放疗增加肿瘤特异性抗原,考虑肠道菌群移植等。如果应对策略找对了,TIGIT抑制剂或者其他ICIs 抑制剂的曙光将会离我们更近,广大的患者也会有更多更好的选择。
1.Mullard A.Immuno-oncology target TIGIT attracts a new contender.Nat Rev DrugDiscov.2021.Aug;20(8):576.
2.DEREK LOWE:TIGIT Troubles.5/12/2022. https://www.science.org/content/blog-post/tigit-troubles.
3.Bendell JC, Bedard P, Bang YJ, et al: Phase Ia/Ib dose-escalation study of the anti-TIGITantibody tiragolumab as a single agent and in combination with atezolizumab in patients with advanced solid tumors. 2020 AACR Virtual Annual Meeting II. Abstract CT302.
4.By Alice Goodman.August 10, 2020. Anti-TIGIT Antibody Plus Atezolizumab MoveForwardin Advanced NSCLC.
5.https://www.genentechoncology.com/pipeline-molecules/tiragolumab.html
6.TIGIT/CD226 Axis Regulates Anti-Tumor Immunity. Pharmaceuticals 2021, 14, 200.
7.Mechanistic convergence of the TIGIT and PD-1 inhibitory pathways necessitates co-blockade to optimize anti-tumor CD8+ T cell responses.Immunity 55, 512-526, March 8, 2022
8.Yeo J, Ko M, Lee DH, etal. TIGIT/CD226 Axis Regulates Anti-Tumor Immunity.Pharmaceuticals (Basel). 2021 Feb 28;14(3):200.
9.Banta KL, Xu X, Chitre AS, et al. Mechanistic convergence of the TIGIT and PD-1inhibitory pathways necessitates co-blockade to optimize anti-tumor CD8+ T cell responses. Immunity. 2022 Mar 8;55(3):512-526.e9.
责任编辑:肿瘤资讯-Joe
排版编辑:肿瘤资讯-LH
版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。