在当今肿瘤免疫治疗时代,免疫检查点抑制剂为肿瘤患者带来了生存获益的突破性进展,其中最为人熟知的当属程序性细胞死亡蛋白1(PD-1)/程序性细胞死亡配体1(PD-L1)抑制剂。而随着探索的不断深入,其他新兴免疫检查点抑制剂也越来越受到关注,T细胞免疫球蛋白和ITIM结构域(TIGIT)抗体便是其中备受期待的焦点之一。
作为一种共抑制受体,TIGIT高表达于肿瘤患者的免疫细胞表面,其可通过抑制免疫细胞功能参与免疫抑制并造成肿瘤免疫逃逸。目前,全球已有多款抗TIGIT抗体进入临床试验,但尚无药物获批上市。此前公布的数据中,罗氏开发的抗TIGIT抗体Tiragolumab在多个瘤种中均显示出不俗疗效,在肺癌领域的探索更是已至Ⅲ期临床试验,引发学界热切关注。然而,Tiragolumab联合阿替利珠单抗在非小细胞肺癌中的Ⅲ期临床研究Skyscraper01 近期公布其共同主要终点之一的无进展生存(PFS)未达到统计学差异,另一主要终点OS未成熟,仍在随访中。一时间,质疑声四起,似乎TIGIT研究陷入僵局。
在此背景下,本文将以抗TIGIT抗体的机制作为切入点,回顾抗TIGIT抗体Tiragolumab相关临床研究,探索其治疗潜力。
原发性肺癌是我国最常见的恶性肿瘤之一,其发生率和死亡率位居所有恶性肿瘤之首。近年来,随着肿瘤免疫学的迅速发展,免疫治疗为晚期肺癌患者带来了新的曙光。以程序性细胞死亡蛋白1(PD-1)/程序性细胞死亡配体1(PD-L1)、细胞毒性T淋巴细胞相关蛋白4(CTLA-4)等为靶点的免疫检查点抑制剂进一步丰富了晚期NSCLC治疗手段,改变了患者治疗现状。
然而不可否认的是,晚期NSCLC免疫治疗中仍有诸多困境有待突破,包括免疫单药客观缓解率(ORR)改善仍有限,大约仅20%~50%[1-3];免疫联合治疗虽能提升ORR,但现有联合方案往往也会增加不良反应的发生率及严重程度,许多患者因治疗不耐受而停药;此外,免疫治疗的获得性耐药仍然存在,仅有少部分患者能够从治疗中持续获益。
在此背景下,学界将目光投向新兴的靶点,不同靶点抑制剂的联合方案成为探索的热门思路,TIGIT单抗与现有免疫检查点抑制剂的联合当属于其中的后起之秀。
TIGIT是一种新型抑制受体,其属于脊髓灰质炎病毒受体(PVR)/ nectin家族成员,在多种免疫细胞上表达,包括T细胞和NK细胞[4-6]。TIGIT由细胞外免疫球蛋白可变区(IgV)结构域、1型跨膜结构域和具有经典免疫受体酪氨酸抑制基序(ITIM)和免疫球蛋白酪氨酸尾基序的细胞内结构域(ITT)组成[6]。TIGIT主要作用的配体是PVR(CD155),也可与CD112、CD113、CD226相互作用,调节免疫应答。
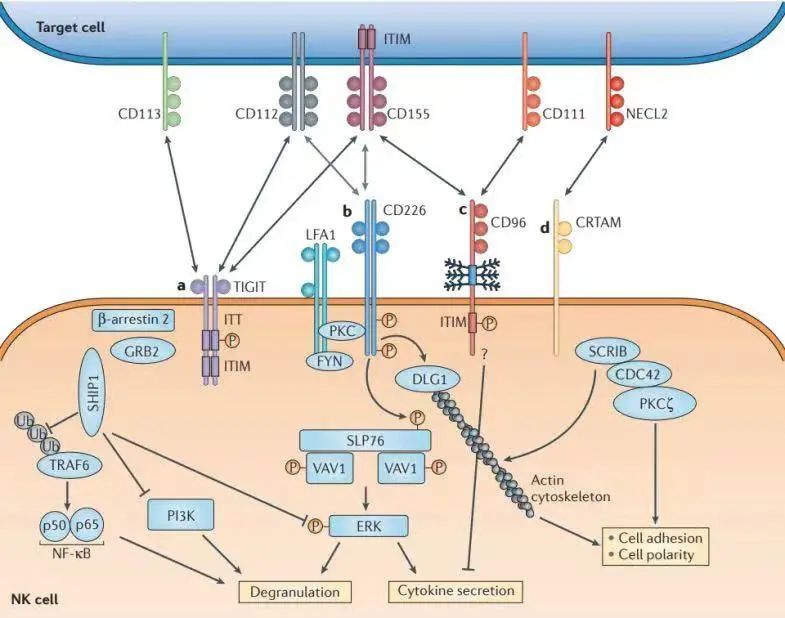
TIGIT可能通过多种机制抑制免疫细胞的功能[7],包括与细胞膜上的CD155结合,下调T细胞和NK细胞免疫调节功能,诱导免疫耐受状态;与CD226竞争性结合CD155,进而引起细胞内信号通路的活化;抑制树突细胞(DC)、NK细胞及T淋巴细胞,在肿瘤免疫的多个环节中起到免疫抑制作用[4]。
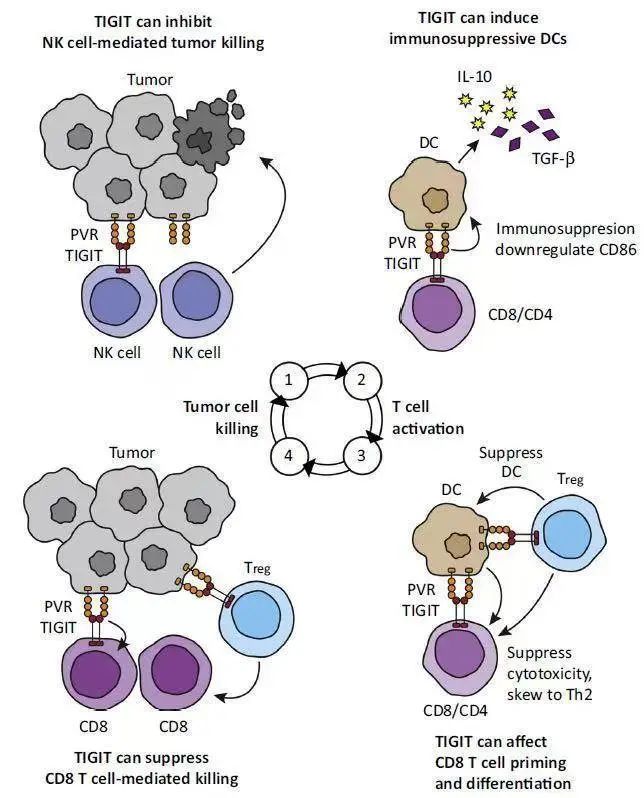
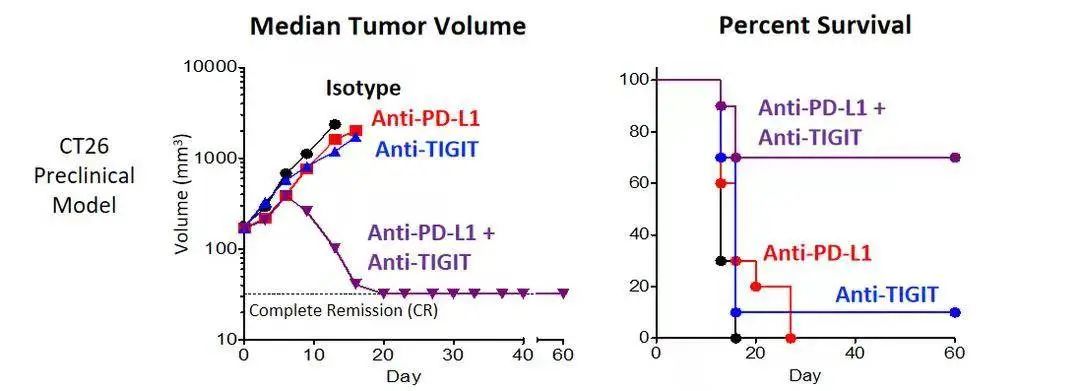
此外,TIGIT表达与PD-1相关,特别是在肿瘤浸润淋巴细胞(TIL)中,TIGIT经常与PD-1在同一细胞上共表达。同时阻断TIGIT和PD-L1可能增强NK细胞的抗肿瘤活性并激活T细胞,获得原发性或获得性抗肿瘤免疫效应,并增强PD-L1单抗疗效。相关研究表明[8],PD-L1单抗联合抗TIGIT抗体不仅能增加淋巴结中IFN-γ+ CD8+ T细胞,还可增加肿瘤中IFN-γ+CD8+ T细胞浸润。在CT26荷瘤小鼠模型中[8],抗TIGIT抗体与PD-L1单抗联合治疗具有协同效应,通过CD8+T细胞激活肿瘤免疫,提高肿瘤控制率,改善生存。这些研究为抗TIGIT抗体与免疫检查点抑制剂的联合应用提供了扎实理论基础。
锋芒初露,Tiragolumab在PD-L1阳性NSCLC人群展现出色疗效
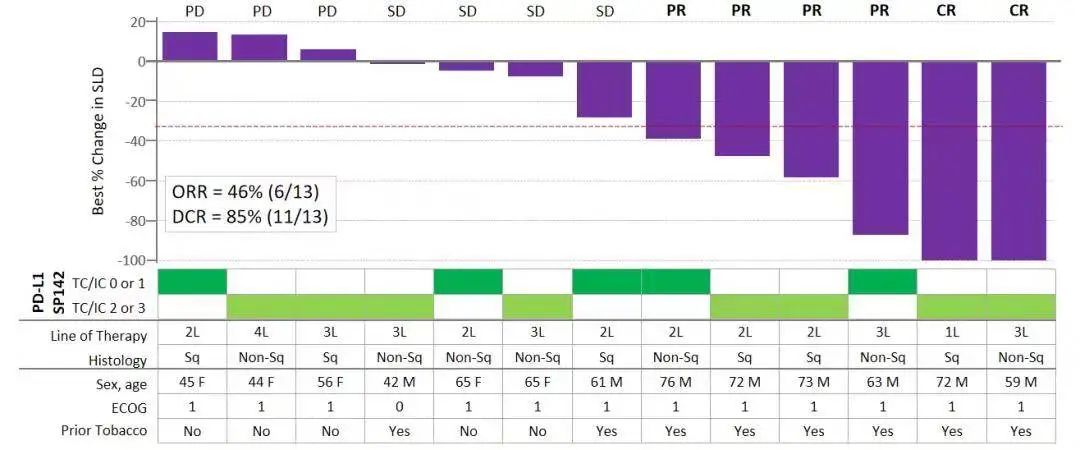
Tiragolumab作为一种全人源化IgG1/kappa 抗TIGIT抗体,具有完整的Fc区,可阻断TIGIT与其配体PVR和共激活受体CD226的结合。在Tiragolumab联合PD-L1抗体阿替利珠单抗治疗实体瘤的I期临床研究(GO30103,NCT02794571)中,该联合方案展现出良好的耐受性,并且在多种瘤种中显示出抗肿瘤活性。在Ib期剂量扩展阶段,研究入组了13例未接受过免疫治疗的PD-L1阳性NSCLC患者,ORR达46%(6/13),DCR达85%(11/13);13例患者均接受PD-L1(SP142)检测,其中PD-L1中高表达(TC/IC 2或3)患者8例,有2例达到CR。
基于Ⅰ期临床研究结果,开展了一项全球多中心、Ⅱ期临床研究CITYSCAPE(NCT03563716),进一步探索Tiragolumab联合阿替利珠单抗一线治疗PD-L1阳性(22C3 TPS≥1%)晚期NSCLC患者的疗效和安全性。研究共入组135例IV期NSCLC患者,以1:1比例分别接受Tiragolumab联合阿替利珠单抗或安慰剂联合阿替利珠单抗治疗,直至疾病进展或失去临床获益。主要终点是ORR和PFS,次要终点包括安全性和总生存期(OS)等。
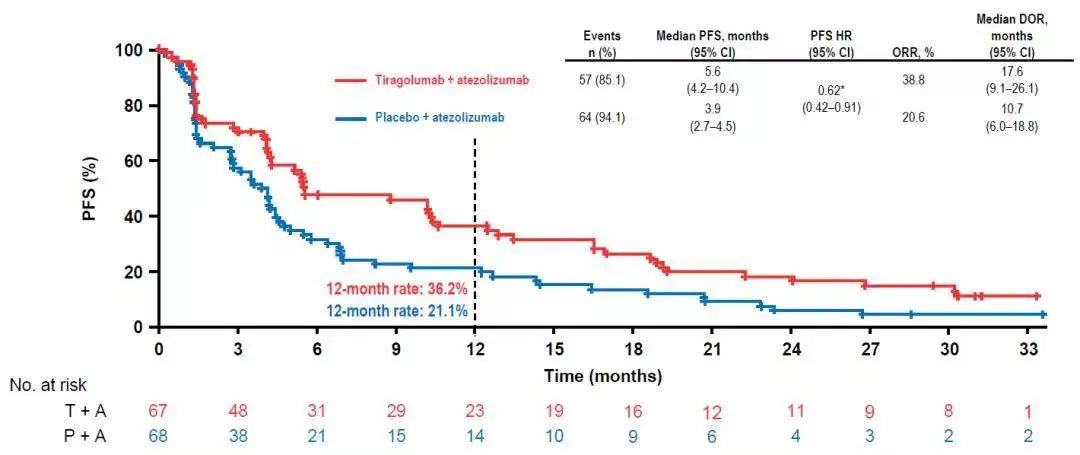
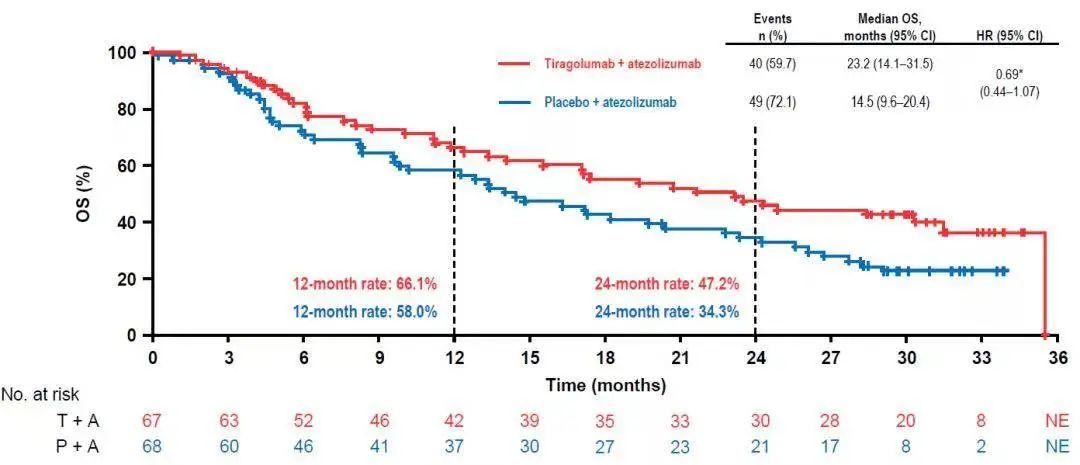
研究结果显示,至数据截止日期(2021年8月16日),在意向治疗人群(ITT)中(PD-L1 22C3 TPS ≥ 1%),接受Tiragolumab联合阿替利珠单抗治疗(治疗组)的患者ORR达38.8%,显著高于安慰剂联合阿替利珠单抗治疗(对照组)的患者(20.6%);治疗组的中位PFS达5.6个月,相较于对照组中位PFS 3.9个月亦有显著延长(HR 0.62)。此外,治疗组的中位OS达23.2个月,与对照组中位OS 14.5个月相比,也有明显延长(HR 0.69)。
ITT人群(PD-L1 22C3 TPS ≥1%)
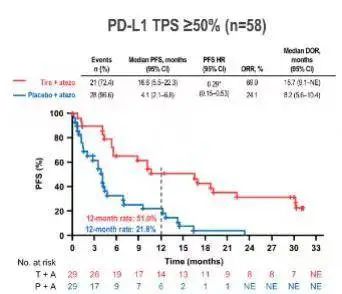
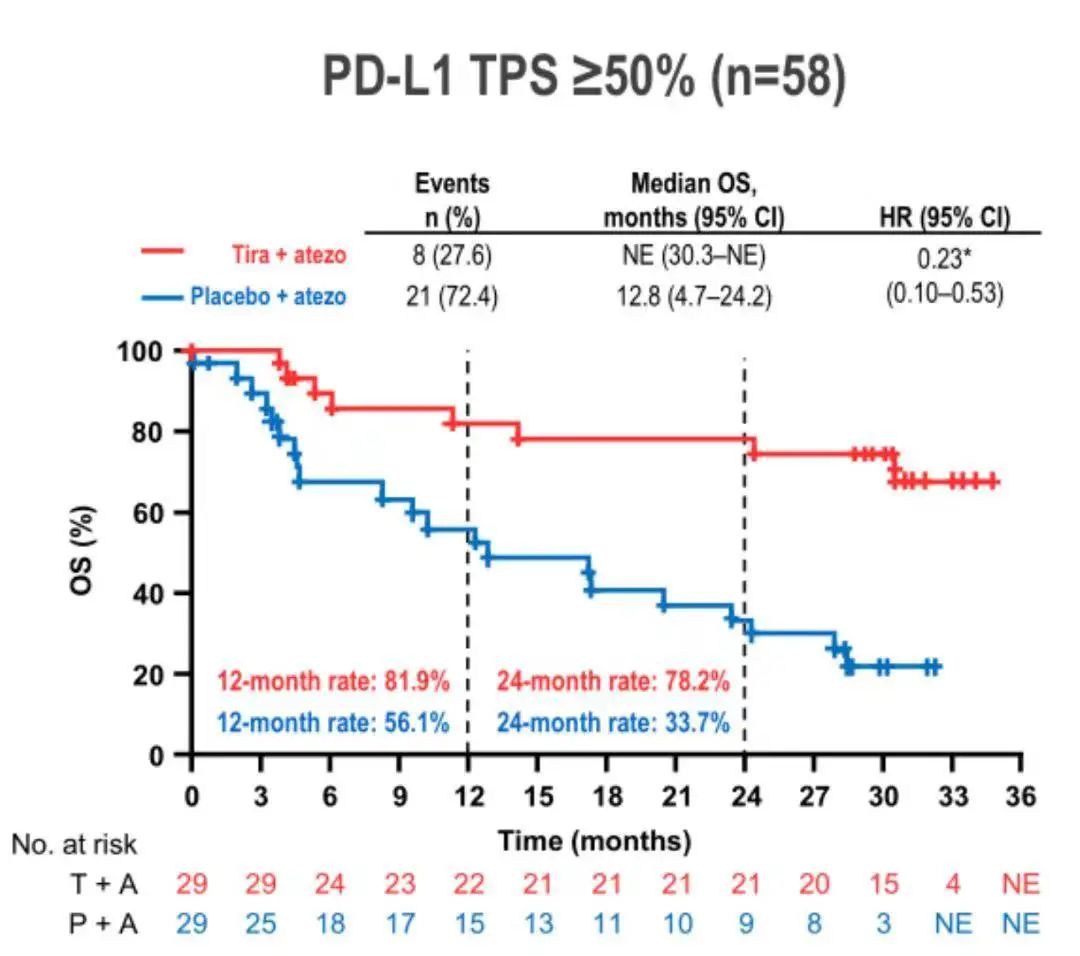
值得一提的是,PD-L1高表达(22C3 TPS ≥ 50%)亚组患者的临床获益更为显著。治疗组的ORR高达69%(VS. 对照组24.1%),中位PFS高达16.6个月(VS. 对照组4.1个月),疾病进展或死亡风险降低71%(HR 0.29),中位OS尚未达到(VS. 对照组12.8个月),死亡风险降低77%(HR 0.23)。1年OS率及2年OS率分别为81.9%(VS. 对照组56.1%)和78.2%(VS. 对照组33.7%)。由此可见,PD-L1高表达的患者更可能从Tiragolumab联合阿替利珠单抗治疗中获益。
PD-L1高表达亚组
回顾既往报道的针对PD-L1高表达晚期NSCLC的不同探索,PD-1/PD-L1单药或联合治疗的mPFS未超过1年,mOS未超过30个月。虽然不同研究不可直接对比,但单从数据来看,Tiragolumab+阿替利珠单抗这一双免联合方案在CITYSCAPE研究中取得的mPFS 16.6个月,mOS尚未达到但95%置信区间下限已超过30个月,这样的数据无疑是令人振奋的,这一双免联合方案有望成为PD-L1高表达晚期NSCLC患者更优的治疗新选择。
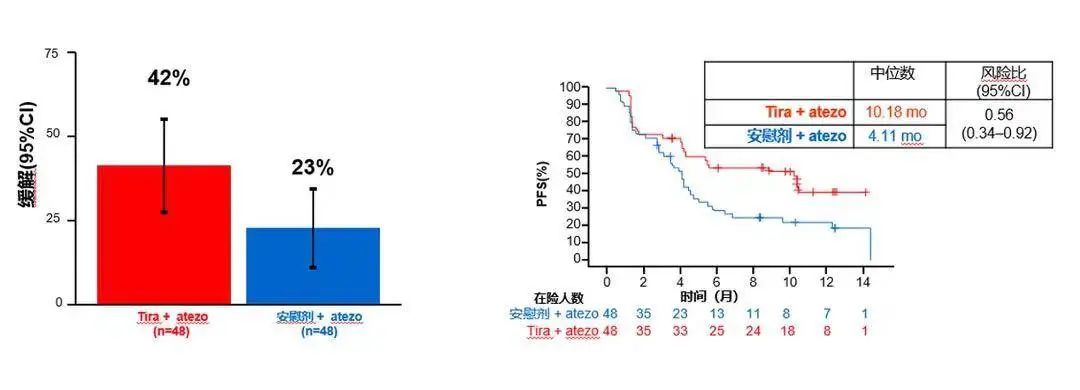
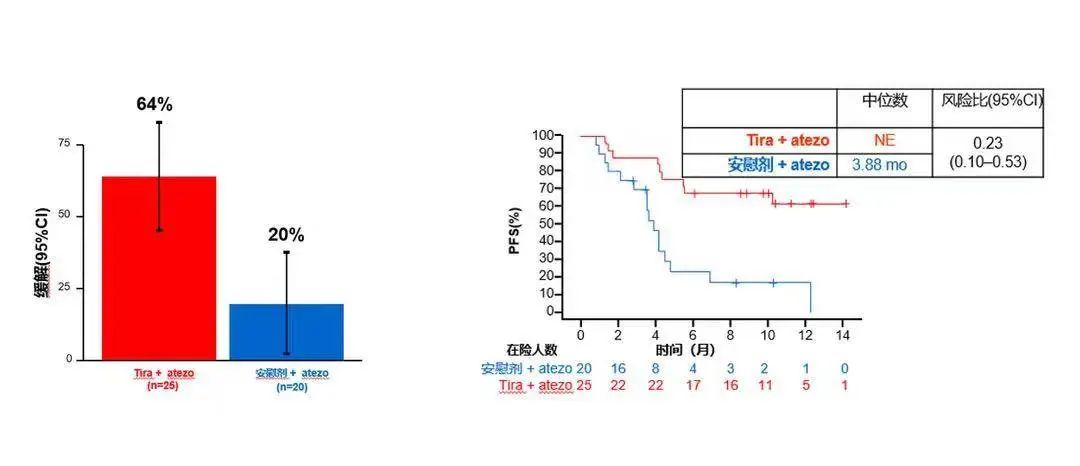
此外,该研究还使用SP263对患者PD-L1表达水平进行了检测,以评估不同检测方法之间结果的一致性。结果显示,在PD-L1 SP263 TC ≥ 1%的患者中,治疗组与对照组的ORR分别为42% vs. 23%,中位PFS分别为10.18个月vs. 4.11个月(HR 0.56)。而在PD-L1 SP263 TC ≥ 50%的患者中,治疗组与对照组的ORR分别为64% vs. 20%,中位PFS分别为尚未达到vs. 3.88个月(HR 0.23)。这些结果与PD-L1 22C3检测所得结果一致。
PD-L1 SP263 TC≥1%
PD-L1 SP263 TC≥50%
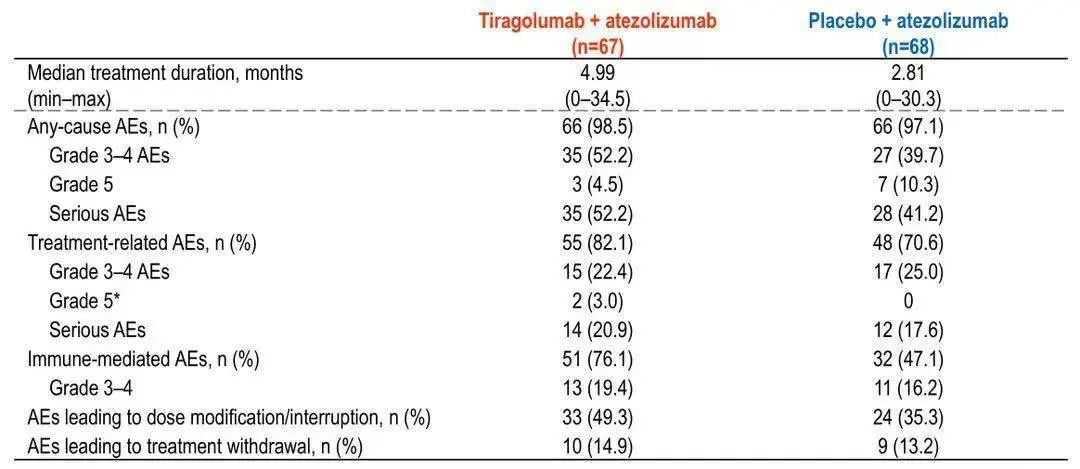
安全性方面,Tiragolumab联合阿替利珠单抗治疗的安全性良好,不良事件发生率与对照组相似。其中,3级及以上的免疫相关不良事件(irAE)发生率与对照组也相当(19.4% vs 16.2%)。考虑到既往双免联合治疗的临床研究中常出现高达30%~50%的3级及以上irAE发生率,因此Tiragolumab联合阿替利珠单抗的安全性更显优势。
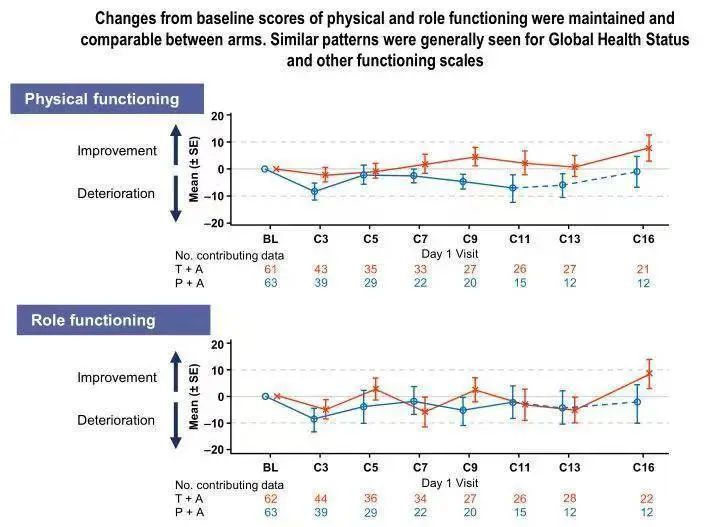
肿瘤患者的生活质量同样备受关注。该研究关于患者生活质量的结果显示,两组患者基线时一般状况及身体功能评分相似,而随着治疗的持续,大体维持了基线时的总体健康状况/QoL和功能评分。
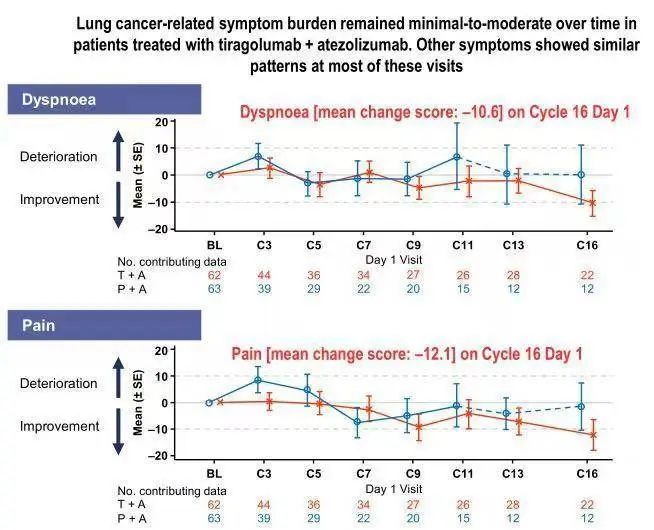
基于CITYSCAPE研究的出色结果,2021年1月5日,FDA授予Tiragolumab突破性疗法认定(BTD),与阿替利珠单抗联合用于PD-L1高表达、无EGFR/ALK基因突变的转移性NSCLC患者的一线治疗。Tiragolumab也成为了第一个也是目前唯一一个获得BTD的抗TIGIT抗体。
山重水复?Tiragolumab III期临床研究结果仍值得期待
鉴于CITYSCAPE研究中Tiragolumab联合阿替利珠单抗在PD-L1阳性晚期NSCLC患者,尤其是PD-L1高表达患者中出色的疗效和具有优势的安全性,罗氏开展了确证性III期临床研究SKYSCRAPER-01证实Tiragolumab联合阿替利珠单抗在PD-L1高表达NSCLC患者中的疗效和安全性。在近期公布的SKYSCRAPER-01中期分析中,共同主要终点之一的PFS未达到预设,另一共同主要终点OS数据尚未成熟。鉴于该研究双终点中有一个终点为阳性即为阳性研究,因此虽然目前数据未达到人们预期,但我们仍期待另一终点OS这一评价疗效的金标准能够在不久的将来传来好消息。
[1] N Engl J Med. 2015 May 21;372(21):2018-28.
[2] N Engl J Med. 2015 Jul 9;373(2):123-35.
[3] N Engl J Med. 2016 Nov 10;375(19):1823-1833.
[4] Trends Immunol. 2017 Jan;38(1):20-28.
[5] Rotte et al. Annals of Oncology 2018.
[6] Nat Immunol. 2009 Jan;10(1):48-57.
[7] 生物技术通讯. 2020,31(6):749-753.
[8] Cancer Cell. 2014 Dec 8;26(6):923-937.
ps:想要了解更多临床试验资讯,请关注公众号【研值Hub】