
2021年美国临床肿瘤学会(ASCO)年会于美国东部时间6月4日-8日如期举行,作为肿瘤学界的年度盛会,ASCO年会汇聚全球专家学者,重磅前沿进展令人目不暇接。肺癌新型免疫治疗领域万众瞩目,为此特邀上海交通大学附属胸科医院陆舜教授为大家介绍AdvanTIG-302研究,这是一项由百济神州自主研发的抗TIGIT单抗Ociperlimab联合替雷利珠单抗对比帕博利珠单抗单药一线治疗PD-L1高表达、不可切除局部晚期/转移性非小细胞肺癌的国际多中心、随机对照Ⅲ期临床研究。
国际肺癌研究会(IASLC)出版委员会委员
Journal of Thoracic Oncology副主编
Lung Cancer副主编
Oncologist 编委
中国抗癌协会肺癌专业委员会主任委员
癌症康复与姑息治疗委员会委员
中华肿瘤协会委员
中国临床肿瘤学会(CSCO)常务理事
希斯科基金会副理事长
中国医药生物技术协会精准医疗分会副主任委员
上海市医学会肿瘤学会主任委员兼胸部肿瘤组组长
上海市医学会理事、抗癌协会理事
国家重点专项首席专家
作为负责人主持科技部国际合作课题1项;国家新药创新重大专项1项,863重大课题子课题2项;国家自然基金面上项目1项
肺癌是全球最常见的癌症(2020年确诊220万例),也是全球癌症死亡的主要原因(2020年死亡180万例)[1],非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)约占肺癌总数的85%,其中局部晚期或转移性患者长期预后较差[2,3]。近年来,PD-1/PD-L1抗体显著改善了NSCLC患者生存,但原发性及继发性耐药限制了部分患者的临床获益,仍亟需进一步的探索[4,5]。
T细胞免疫球蛋白和ITIM结构域蛋白(TIGIT)是淋巴细胞上表达的一种抑制性受体,在多种实体肿瘤中T细胞和自然杀伤细胞表面免疫检查点受体上调,TIGIT和PVR/PVR-2结合进而抑制机体抗肿瘤免疫反应[6,7]。Ociperlimab (BGB-A1217)是一种新型的人源化lgG1型单抗,可以与TIGIT结合,阻断TIGIT与肿瘤细胞表面配体相互作用,并具有高度亲和力和特异性以及完整的Fc效应功能(图1)[8,9]。替雷利珠单抗是一种抗PD-1单克隆抗体,经Fc段改造后消除抗体依赖的细胞吞噬作用。前期研究显示,抗TIGIT和抗PD-1/PD-L1单抗的双靶点联合用药,可以产生协同免疫细胞激活和增强抗肿瘤活性的作用[8,10]。此次ASCO大会公布了一项正在进行的Ⅲ期临床研究AdvanTIG-302,该研究主要探索Ociperlimab联合替雷利珠单抗与帕博利珠单抗相比,在PD-L1高表达、未经治疗的局部晚期或转移性NSCLC患者中的有效性和安全性。
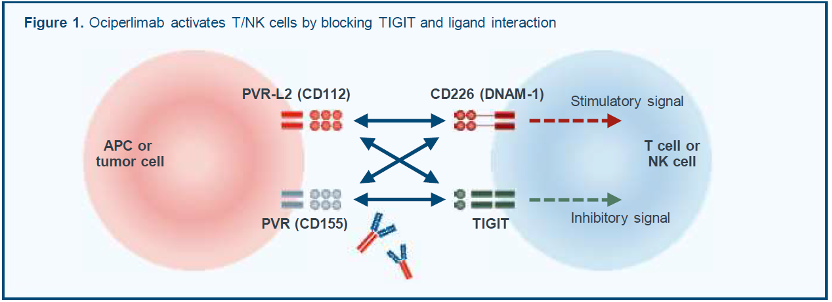
Ociperlimab通过阻断TIGIT与肿瘤细胞表面配体相互作用激活T/NK细胞
AdvanTIG-302(NCT04746924)是一项国际多中心、随机、双盲的Ⅲ期临床研究,目前在全球170家研究中心开展(图2)。
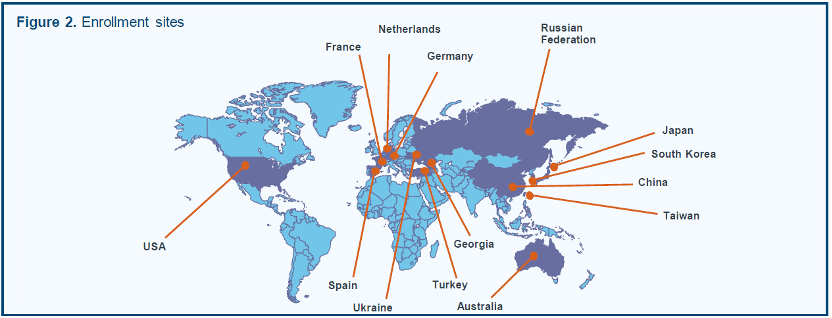
AdvanTIG-302研究中心分布
研究预计总共入组605例经PD-L1筛选的(肿瘤细胞PD-L1表达≥50%)局部晚期(不可切除,不能耐受放疗)或转移性NSCLC患者,并且不伴有EGFR突变或ALK易位。受试者按照5∶5∶1的比例随机入组到Arm A(Ociperlimab联合替雷利珠单抗)、Arm B(帕博利珠单抗+安慰剂)以及Arm C(替雷利珠单抗+安慰剂),分层因素包括组织学类型(鳞状vs非鳞状)和地区(亚洲vs非亚洲)。持续治疗直到发生疾病进展(RECIST v1.1)、不可耐受的毒性、撤回知情同意书或研究者认为患者不再能从研究治疗中获益,研究允许研究者依据RECIST v1.1评估进展后继续治疗,研究不允许交叉治疗。
值得关注的是,替雷利珠单抗单药疗法已被证实在后线NSCLC患者中具有很好的临床获益,并有望在初治的NSCLC患者中获益。Arm C设置的目的是在特定的NSCLC人群中生成替雷利珠单抗单药治疗数据,这样有助于了解替雷利珠单抗和Ociperlimab在Arm A结果中的相对贡献。
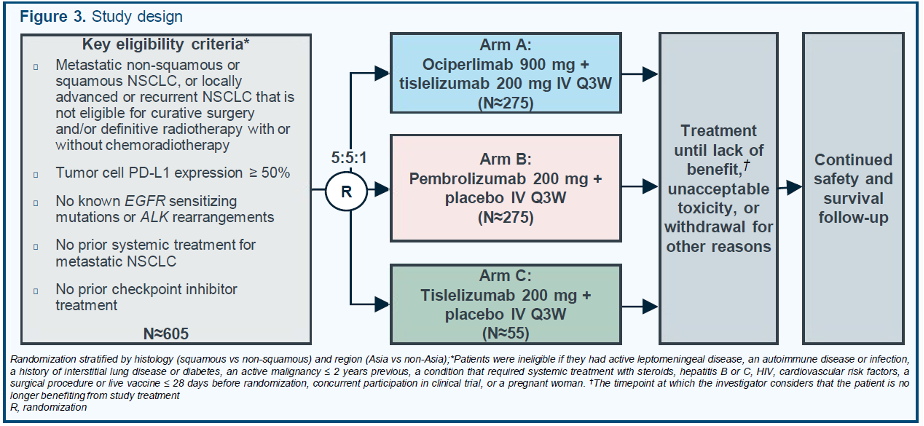
AdvanTIG-302研究设计
1、主要研究终点(双终点设计):
· 研究者评估的无进展生存期(PFS):Arm A vs Arm B(RECIST v1.1);
· 总生存期(OS)为Arm A vs Arm B。
2、次要研究终点及探索性研究终点:
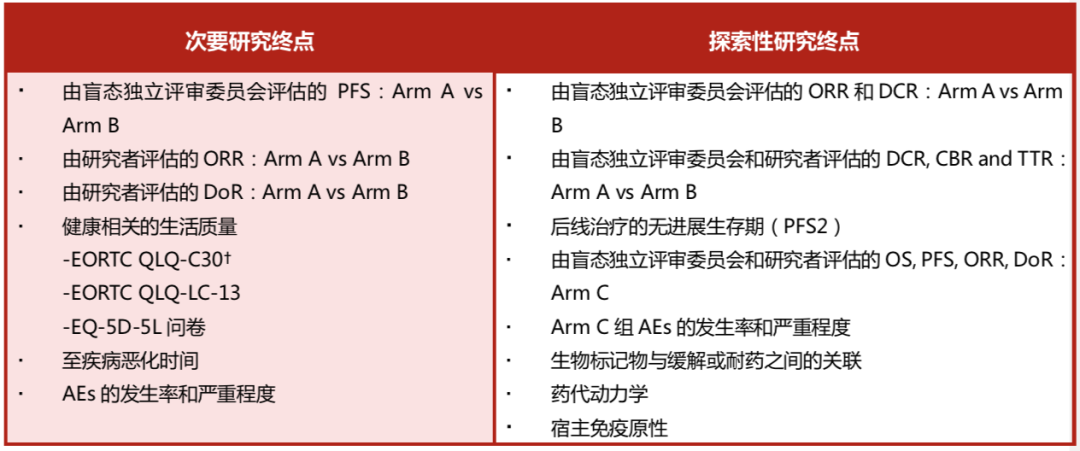
*根据RECIST v1.1;†使用QLQ-C30的全球健康状况量表进行分析
AE,不良事件;BIRC,盲态独立评审委员会;CBR:临床获益率;DCR:疾病控制率;DoR:反应持续时间;EORTC:欧洲癌症研究和治疗组织;EORTC QLQ-C30:EORTC生命质量测定量表;EORTC QLQ-LC-13:肺癌患者生活质量量表13;EQ-5D-5L, 欧洲五维健康量表;ORR:客观缓解率;OS:总生存期;PFS:无进展生存期;PFS2,从随机化到下一疗程治疗后客观疾病进展或因任何原因死亡(以先发生者为准)的时间;TTR,从治疗到疾病缓解的时间。
3、所有与疗效相关的研究终点将在意向治疗分析集(所有随机患者)中进行评估;
4、在研究的第一年,每9周进行一次影像学检查,之后每12周进行一次;
5、肿瘤评估将由研究者和盲态独立评审审查委员会(BIRC)按照RECIST v1.1进行评估;
6、使用安全性分析集(所有接受≥1剂研究药物的患者)进行安全性分析。
1、PFS和OS的双重主要终点将采用Kaplan-Meier方法进行估计,并采用分层log-rank检验进行比较Arm A vs Arm B,使用Cox回归模型估计治疗效果;
2、计划进行两次中期分析:
· 当预期事件发生数量达到目标数量的65%时,将对PFS进行中期分析;
· 在最终PFS分析时,将对OS进行中期分析。
AdvanTIG-302是一项正在进行的国际多中心Ⅲ期研究,目的在于探索Ociperlimab与 替雷利珠单抗联合治疗相比于帕博利珠单抗单药治疗,是否能延长PD-L1高表达、局部晚期/转移性NSCLC患者的PFS及OS。本研究将深入挖掘抗TIGIT抗体和抗PD-1抗体(Ociperlimab和替雷利珠单抗)的双靶点联合用药在一线NSCLC中的作用。
随着免疫治疗的蓬勃发展,TIGIT已成为继CTLA-4、PD-1/L1后另一个备受关注的免疫检查点,免疫双靶点联合治疗也有望成为下一代标准免疫疗法给患者带来长期生存的希望。
由百济神州自主研发的TIGIT抗体Ociperlimab,可有效阻断TIGIT与肿瘤细胞表面配体相互作用,并且具有完整的Fc效应功能;在临床前研究中已显示出良好的抗肿瘤活性,同时与PD-1抗体替雷利珠单抗联合治疗后展示出高效的协同抗肿瘤作用。在此基础上,百济神州目前正在开展的AdvanTIG-302研究是一项国际多中心、随机双盲的Ⅲ期临床研究,旨在评估Ociperlimab与替雷利珠单抗联合对比帕博利珠单抗单药一线治疗PD-L1高表达、局部晚期/转移性NSCLC患者的有效性和安全性。这对于NSCLC患者一线治疗的“去化疗”策略无疑是一个新的突破。
百济神州一直致力于为全球癌症患者带来更好的抗肿瘤药物,Ociperlimab是首个进入临床的由中国自主研发的TIGIT单抗,期待AdvanTIG-302研究可以取得全面成功,双靶点免疫联合策略可以给非小细胞肺癌患者带来更好的临床获益。
1.Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3):209-249.
2.Tun AM , Thein KZ, Thein WL, et al. Checkpoint inhibitors plus chemotherapy for first-line treatment of advanced non-small cell lung cancer: a systematic review and meta-analysis of randomized controlled trials[J]. Future Sci OA, 2019, 5(9):FSO421.
3.Hansen RN, Zhang YD, Seal B, et al. Long-term survival trends in patients with unresectable stage Ⅲ non-small cell lung cancer receiving chemotherapy and radiation therapy: a SEER cancer registry analysis[J]. BMC Cancer, 2020, 20(1):276.
4.Santini FC, Hellmann MD. PD-1/PD-L1 Axis in Lung Cancer[J]. Cancer J, 2018, 24(1):15–19.
5.Sui HS, Ma NX, Wang Y, et al. Anti-PD-1/PD-L1 Therapy for Non-Small-Cell Lung Cancer: Toward Personalized Medicine and Combination Strategies[J]. J Immunol Res, 2018, 2018:6984948.
6.Manieri NA, Chiang EY, Grogan JL, et al. TIGIT: A Key Inhibitor of the Cancer Immunity Cycle[J]. Trends Immunol, 2017, 38(1):20–28.
7.Harjunpää H, Guillerey C. TIGIT as an emerging immune checkpoint[J]. Clin Exp Immunol, 2020, 200(2):108–119.
8.Chen X, Xue L, Ding X, et al. A Fc-competent anti-human TIGIT blocking antibody BGB-A1217 elicits strong immune responses and potent anti-tumor efficacy in pre-clinical models[EB/OL]. AACR 2021, abstract 1854.
9.Johnston RJ, Comps-Agrar L, Hackney J, et al. The immunoreceptor TIGIT regulates antitumor and antiviral CD8(+) T cell effector function[J]. Cancer Cell, 2014, 26(6):923–937.
10.Rodriguez-Abreu D, Johnson ML, Hussein MA, et al. Primary analysis of a randomized, double-blind, phase II study of the anti-TIGIT antibody tiragolumab (tira) plus atezolizumab (atezo) versus placebo plus atezo as first-line (1L) treatment in patients with PD-L1-selected NSCLC (CITYSCAPE)[J]. J Clin Oncol, 38, 2020 (suppl 15; abstr 9503).
版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。