2021年2月26日/医麦客新闻 eMedClub News/--致力于开发下一代CAR-T疗法的临床阶段生物技术公司Curocell, Inc.近日(2021年2月22日)宣布,韩国食品药品管理局(Ministry of Food and Drug Safety,MFDS)已批准其CD19 CAR-T细胞治疗CRC01,用于复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)患者的1/2期临床研究申请。这项试验计划将在韩国招募多达100名弥漫性大B细胞淋巴瘤(DLBCL)患者,预期将于2021年上半年启动。
CRC01基于Curocell公司与韩国科学技术院(KAIST)共同开发的“first-in-class”CAR-T平台——OVIS™。Curocell拥有CRC01和OVIS™的全球开发和商业化权利。
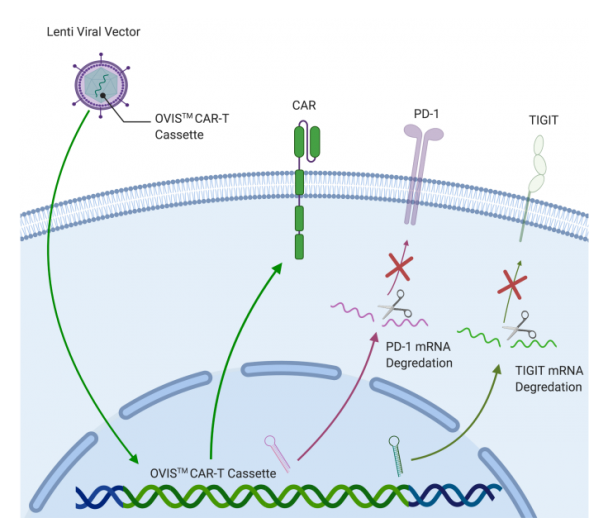
OVIS™利用慢病毒载体将CAR转导进T细胞,并在同一载体中下调PD1和TIGIT。该技术旨在增强免疫细胞,克服肿瘤微环境中的免疫抑制作用。同时,这一CAR-T平台也能够实现经济、高效且简单的生产。
▲ 图片来源:Curocell官网
Curocell公司首席执行官Gunsoo Kim表示:“我们很高兴获得韩国首个CAR-T疗法的IND许可。OVIS™是结合免疫检查点受体抑制的独特CAR-T平台。这项创新的技术有望为传统CD19 CAR-T难以治疗的患者带来突破。”
生物药创新技术大会(BPIT)即将于2021年4月9日-10日在上海拉开序幕,四大分会场,精彩纷呈(点击查看焦点议题)。成功报名上海2021 BPIT大会的参会嘉宾,在大会现场可获赠由医麦客传媒旗下星耀研究院出品的《CAR-T细胞治疗产业研究报告》2021.V3.1限量版。点击文末“阅读原文”,立即报名!
嵌合抗原受体(CAR)T细胞疗法是一种通过将T细胞体外加工改造实现肿瘤靶向杀伤的免疫治疗技术。但改造后回输至体内的CAR-T细胞往往会出现肿瘤免疫逃逸现象,导致复发或治疗无效,因此也出现了与免疫检查点抑制剂(如PD-1/L1抗体)联合治疗等方案。其实,肿瘤逃避免疫系统的机制与肿瘤微环境(TME)息息相关。研究显示,肿瘤细胞可采用多种方式逃避免疫系统的攻击。靶向TME中的免疫抑制通路能够引起进展期患者体内持续的抗肿瘤应答,对于癌症进展方面同样有着非比寻常的重要性。肿瘤微环境(TME)是肿瘤赖以生存的复杂环境,主要由多种不同细胞外基质(ECE)和基质细胞组成。越来越多的研究证明,TME可以决定肿瘤的异质性,并在随后的肿瘤发展和肿瘤细胞的转移中发挥关键作用,可以说是肿瘤的帮凶。因此,理解肿瘤细胞在肿瘤微环境中如何与其他细胞进行相互作用并完成免疫逃逸是攻克肿瘤的重要一步。· 树突状细胞摄取肿瘤抗原后进入淋巴结递呈给T细胞;这3个过程任何一个受到肿瘤微环境的干扰和抑制,机体的免疫系统就不能有效地识别和杀伤肿瘤细胞。而恶性肿瘤巧妙的利用免疫抑制微环境来逃避免疫系统的抗肿瘤反应。免疫逃逸的机制包括改变G1调节蛋白表达,抑制因子的产生,如IL-10、TGF-β、IDO,以及免疫抑制受体的过表达,例如程序性细胞死亡配体1(PD-L1)、带有Ig和ITIM结构域的T细胞免疫受体(TIGIT)、调节性T细胞(Treg)募集等。为克服TME的挑战,现代科学也在不断为CAR-T疗法发现和验证新的策略。➤➤➤北卡罗来纳大学莱恩伯格综合癌症中心(UNC Lineberger Comprehensive Cancer Center)的科学家们发现,将CAR-T细胞疗法结合STING激活剂可以增强工程化T细胞治疗小鼠乳腺癌的能力。该论文在2021年1月发表于Journal of Experimental Medicine。
干扰素基因刺激蛋白(Stimulator of interferon genes, STING)激活剂是人类固有免疫系统的组分。在人体出现感染期间STING能够被激活,从而诱导I型IFN(干扰素)、细胞因子和T细胞募集因子的表达,并通过一系列的级联反应,激活适应性免疫系统,活化T细胞。
研究中,结合STING激活剂cGAMP的CAR-T细胞在TME中的持久性增强,大大提高了肿瘤控制率。在注射cGAMP的小鼠中,T细胞增殖增强,能够浸润到肿瘤部位,最终肿瘤生长显著减少,存活期延长。不过,研究人员发现,只有在结合cGAMP的CAR-T细胞治疗中加入抗PD-1和抗GR-1单抗才能在人类中实现肿瘤的持续消退。
➤➤➤宾夕法尼亚大学医学院的研究团队于2020年11月在Nature Cancer杂志上在线发表了一项新的研究发现,将CAR-T细胞与PAK4抑制剂药物结合使用,可使这种工程细胞穿透并攻击肿瘤,从而显著增强了小鼠的存活率。
肿瘤内皮细胞(ECs)中促血管生成通路的激活和基因重编程可能导致血管异常,促进免疫不良的微环境的形成,并诱导对免疫治疗的抵抗。在这项研究中,研究团队基于胶质母细胞瘤(GBM)进行了相关探索。结果发现p21活化激酶4 (PAK4)是基因重编程和异常血管形成的选择性调控因子,PAK4此前曾被证明是实体肿瘤生长的驱动因素。
文章作者表示,靶向PAK4可能为修复肿瘤微环境提供了一个独特的机会,同时也为改善基于T细胞的实体瘤癌症免疫疗法提供了急需的机会。
推荐阅读:宾大团队发文:改善CAR-T治疗实体瘤的新策略,靶向PAK4重构肿瘤血管微环境丨医麦猛爆料
➤➤➤
由希望之城研究团队在2020年9月,以封面论文的形式在著名期刊Science Translational Medicine上发表了一篇溶瘤病毒联合CAR-T细胞疗法成功靶向和根除实体瘤的突破性进展研究论文。
研究显示:使癌细胞表达缩短版的CD19( CD19t)的溶瘤病毒OV19t和CD19 CAR-T联合使用时,癌细胞被广泛杀死;OV19t和CD19 CAR-T产生了强大的协同效应,治愈了超过一半的小鼠,~60%的小鼠完全缓解,而仅22%单独接受OV19t治疗的小鼠肿瘤完全消退。
溶瘤病毒可以选择性地感染肿瘤细胞,在其内大量复制并最终裂解肿瘤细胞,同时会大量释放肿瘤抗原,改善肿瘤微环境。有临床证据表明,溶瘤病毒可以加强肿瘤对免疫调节检查点抑制剂、CAR-T细胞等免疫治疗方法的反应率,是联合治疗策略中的理想对象。
推荐阅读:肿瘤免疫联合疗法是未来的主流研究方向,溶瘤病毒+CAR-T/NK细胞疗法会是实体瘤克星吗?丨医麦新观察
参考资料:
1.https://www.prnewswire.com/news-releases/curocell-announces-korean-fda-clearance-of-the-ind-for-crc01-a-first-in-kind-immune-checkpoint-receptors-downregulated-cd19-car-t-therapy-301232233.html
2.https://curocellbtx.com/en/rnd/#tech

医麦客始终致力于生物创新药的前沿技术、行业动态、产业洞察等原创新闻报道,全媒体高端矩阵用户达16万+,其中工业用户占比超50%,科研与临床用户约为30%,投资机构用户超过5%。为促进产业细分领域的互动交流,我们组建了多个专业微信群,欢迎扫码加群。
 点击“阅读原文”,立即报名!
点击“阅读原文”,立即报名!