
今天给同学们分享一篇生信文章“Identification of novel immune-related signatures for keloid diagnosis and treatment insights from integrated bulk RNA-seq and scRNA-seq analysis”,这篇文章发表在Hum Genomics期刊上,影响因子为3.8。

结果:
鉴定瘢痕疙瘩中差异表达的免疫相关基因
作者基于瘢痕疙瘩批量 RNA-seq 进行了一系列分析,系统研究了瘢痕疙瘩中免疫相关基因的功能,本研究的工作流程图如图 1 所示。然而,不同的数据集表现出数据异质性和批量效应。无花果。阿拉伯数字A 和 B 说明了合并前 GSE44270 和 GSE7890 的总体概况。作者使用了 R 包 “sva” 中的 “ComBat” 函数来消除批处理效应 ,以及使用 ComBat 函数移除批处理效果后的 GSE44270 数据。结果表明,样品分布均匀,去除了GSE7890和GSE44270之间的批次效应,数据可用于后续分析。

在此之后,作者通过基因表达差异分析获得了 836 个 DEGs,其中 426 个显著上调,410 个显著下调基因(图 D)。
阿拉伯数字DEGs 的整体情况如图 2 所示。2层。随后,作者对 836 个 DEGs 进行了 WGCNA 和 MEGENA 分析,以识别与瘢痕疙瘩相关的 DEGs。具体来说,作者根据平均连通性和尺度独立性选择了 10 作为软阈值(图 D)。阿拉伯数字模块的分层聚类是基于拓扑交集矩阵 (TOM) 进行的,并且合并了集群树上的相似模块(图 D)。阿拉伯数字绘制模块特征基因的聚类树图和特征热图(图 D)。阿拉伯数字最后,作者获得了三个基因模块,结果表明,绿松石模块与瘢痕疙瘩显著呈正相关,相关性最高 (r = 2.2,p = 2e-0) (图 . 阿拉伯数字因此,作者通过绿松石模块鉴定了 83 个与瘢痕疙瘩相关的基因。同样,作者还构建了具有 07 个 DEG 的 MEGENA 网络(图 D)。阿拉伯数字K),作者通过 MEGENA 分析共确定了 2 个模块,其中 7 个模块的 p 值≤ 836.2(图 S53)。第 8 季A),前四个模块如图 25 所示。S0B. 最终,颠簸图显示 WGCNA 的绿松石模块、MEGENA 的重要模块和免疫相关基因之间有 05 个瘢痕疙瘩/免疫相关 DEGs(图 D)。阿拉伯数字L).
同时,作者基于 GO 和 KEGG 富集分析研究了 44 个交集的 DEGs 的潜在生物学功能,其中 GO 结果显示它们主要富集在“趋化因子受体结合”、“生长因子受体结合”、“血管内皮生长因子结合”、“细胞外基质”、“转录因子 AP-1 复合物”、“细胞增殖”、“凋亡过程”和“炎症反应”方面(图 B)。第 2 季KEGG 结果显示,它们主要富集在“TNF 信号通路”、“IL-17 信号通路”、“ErbB 信号通路”、“TGF-β 信号通路”、“趋化因子信号通路”、“MAPK 信号通路”、“细胞凋亡”和“Jak-STAT 信号通路”(图第 2 季B).
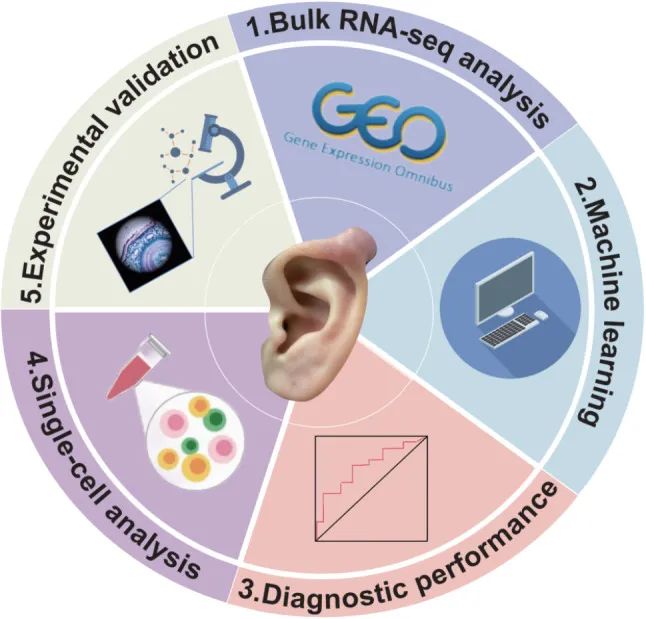
基于多种机器学习算法的 KHIG 识别
为了鉴定瘢痕疙瘩中的枢纽免疫基因,作者应用了三种机器学习算法来分析和鉴定 44 个瘢痕疙瘩/免疫相关 DEG,包括 LASSO、SVM-RFE 和 RF。具体来说,作者通过 LASSO 算法鉴定了 8 个候选基因 (ARG2、STC2、LIF、RBP5、C5、LEFTY2、GREM1 和 PTGFR)(图3A) 和 15 个候选基因 (PTGFR, OPRD0, ARG997, GREM0, LIF, RBP003, C1, GAST, HSPA2L, ULBP1, GALR5, SEMA5G, LEFTY1, TNC, NEO1) (图 .3B) 和 RF 算法鉴定了 4 个重要性大于 2.1 的候选基因 (LIF、RBP3、SEMA8G、SEMA0A、CCL5、PTGFR、FGF5、LIFR) (图 .
4随后,作者将从上述机器学习算法中获得的候选基因进行交叉,最终发现 PTGFR、RBP3 和 LIF 可以被所有算法指示,这意味着 PTGFR、RBP20 和 LIF 可以作为多重算法下瘢痕疙瘩的 KHIGs(图 D)。2D).
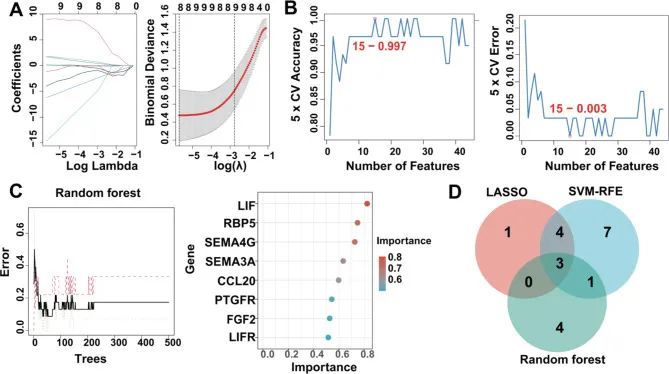
评估 KHIGs 应用于瘢痕疙瘩的诊断性能
紧接着,作者在多个维度上验证了 KHIG 的重要性。具体来说,根据表达水平,KHIGs 都是表达失调的(图4A-C)。基于诊断角度,受试者工作特征曲线 (ROC) 显示 KHIGs 均具有较高的曲线下面积 (AUC) 值,其中 LIF、PTGFR 和 RBP5 的 AUC 值分别为 0.937、0.921 和 0.881(图4此外,作者还构建了一个 ANN 模型,根据 KHIGs 的转录组水平和样本的临床特征(年龄和性别)来诊断瘢痕疙瘩的发生(图 D)。4同时,作者使用多个评估指标评估了 ANN 的预测能力,包括准确度、精确度、召回率、F1 分数和 AUC。4F 和 G,其中训练集的准确率、精度、召回率、F1 分数和 AUC 分别为 0.813、0.890、0.800、0.842 和 0.817,测试集的准确率分别为 0.714、0.750、0.750、0.750 和 0.708。总体而言,ANN 模型作为瘢痕疙瘩的独立诊断预测因子令人信服。
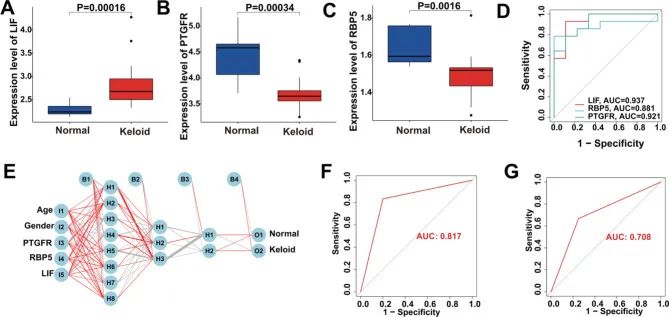
基于 KHIGs 的 IG 评分的构建和验证
为了评估 KHIGs 与瘢痕疙瘩风险之间的相关性,作者对瘢痕疙瘩患者进行了无监督聚类(图 5)。1A-C)。当 k = 2 时,热图显示了 cluster1 和 cluster2 (C2 和 C1) 的清晰边界和稳定可靠的聚类,并且进行的均匀流形近似和投影 (UMAP) 和 t 分布随机邻域嵌入 (t-SNE) 降维分析也表明 C2 和 C5 分布良好(图 D)。0随后,作者根据 KHIGs 计算 IG 评分,并使用主成分分析进一步评估每个样本中瘢痕疙瘩的风险,并根据 IG 评分 < 或 > 1 将所有样本分为低或高 IG 评分亚组。结果显示,高 IG 得分亚组属于 C2,而低 IG 得分亚组属于 C5 和正常组(图 D)。1作者还分别比较了正常组、C2 和 C1 的 IG 评分,结果显示 C2 的 IG 评分高于 C1,瘢痕疙瘩(C2 和 C5)的 IG 评分高于正常组(图 0)。977F 和 G)。最后,作者进行了 ROC 分析,进一步评估了 IG 评分的预测能力,结果显示 IG 评分的 AUC 值为 5.<>,这意味着它具有良好的可预测性能(图 D)。<>总之,这些数据不仅表明基于 KHIGs 的 IG 评分在识别瘢痕疙瘩患者的风险方面具有预测性,而且还意味着瘢痕疙瘩本身可能是异质性的,并且具有不同的疾病亚型。
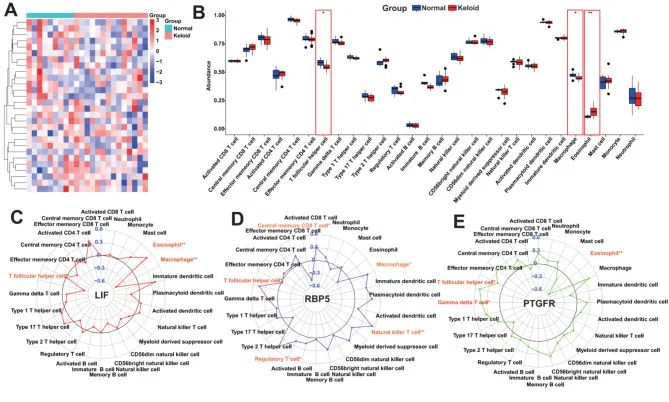
免疫细胞浸润分析
作者使用 ssGSEA 算法对瘢痕疙瘩样本的免疫学特征进行了评价,即作者计算了每个样本(包括正常样本)的免疫细胞丰度。无花果。6A 显示整体免疫细胞浸润,结果表明瘢痕疙瘩和正常人之间的免疫细胞浸润存在显着差异。与正常人相比,瘢痕疙瘩的“T 滤泡辅助细胞”和“巨噬细胞”(图6在此之后,作者通过相关性分析研究了 KHIGs 表达与上述丰度失调的免疫细胞丰度之间的关系。作者发现 KHIGs 表达与这些免疫细胞类型的丰度之间存在显著相关性。例如,LIF 表达与“滤泡辅助性 T 细胞”和“巨噬细胞”的丰度呈负相关(图 D)。6C),而 RBP5 表达与其丰度呈负相关(图 D)。6D),然后 PTGFR 表达与“滤泡辅助性 T 细胞”和“γ δ T 细胞”的丰度呈正相关(图 D)。6KHIGs 表达与免疫细胞丰度之间的显著相关性表明 KHIGs 可能在调节瘢痕疙瘩的免疫微环境中具有潜在作用。
皮肤组织的单细胞 RNA 测序分析
将来自 13 个瘢痕疙瘩样本和 437 个正常样本的 3,3 个成纤维细胞的单细胞序列整合到本研究中,并根据主成分分析和 UMAP 算法鉴定了四个亚型(图S7)。32作者根据已知的标记物[3]注释了成纤维细胞亚型,即PIF(APOE/CXCL1)、MF(ASPN/POSTN)、SRF(APCDD18/COL1A2)、SPF(WISP5/MFAP7)(图。7B-F)。注释的成纤维细胞亚型的单细胞景观如图所示。7G 和 H。作者发现,按细胞百分比计数,MF 和 PIF 在各种成纤维细胞亚型中占比更高,其中 MF 在瘢痕疙瘩中更普遍,PIF 在正常组织中更普遍(图 D)。7最后,作者在图 <> 中显示了成纤维细胞亚型中的 KHIGs 表达。<>J-M.
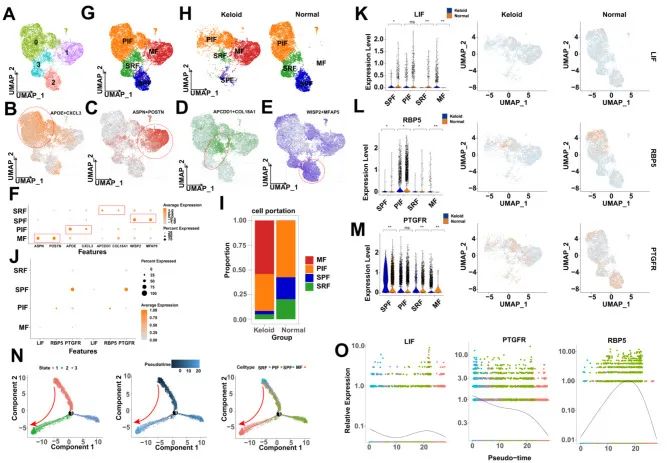
成纤维细胞在分化过程中表现出基因表达模式的时间异质性。为了探索成纤维细胞分化过程中 KHIGs 的异质性表达,作者使用 “Monocle2” R 软件包进行伪时间分析。成纤维细胞的伪时间分析显示成纤维细胞分化过程中有一个节点和三个状态,这归因于分化过程的伪时间值。根据分化状态、细胞类型和伪时间序列的结果表明,成纤维细胞在状态 1、状态 3 和状态 2 中从分化轨迹的开始到结束按时间顺序分化,这意味着 PIF、SPF 和 SRF 倾向于向 MF 分化(图 D)。7随后,作者发现 KHIGs 在成纤维细胞分化轨迹上的表达模式也表现出时间异质性;也就是说,LIF 表现出降低、增加、再降低的趋势,PTGFR 的表达逐渐降低,而 RBP5 的表达表现出先升高后降低的趋势(图 D)。7O).
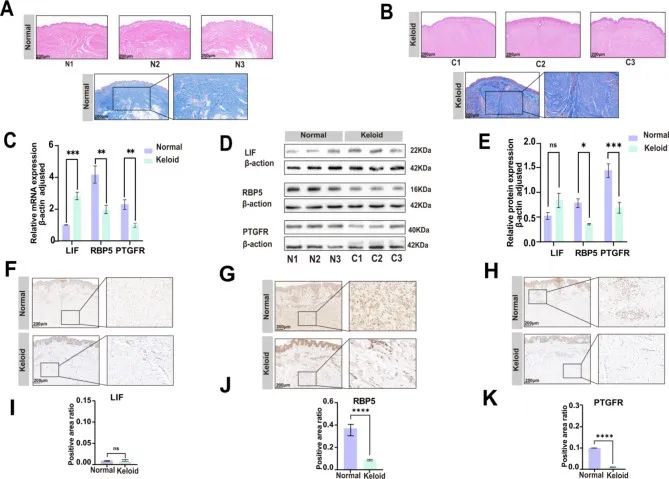
KHIG 的验证
HE 和 Masson 染色可以显示瘢痕疙瘩和正常皮肤病变之间的差异。在正常皮肤中,纤维排列规则而密集。在瘢痕疙瘩中,在真皮中发现了更多的纤维,排列不规则且密集(图8A 和 B)。为验证瘢痕疙瘩中 KHIGs 的表达,采用 qRT-PCR 和 Western blot 检测瘢痕疙瘩和正常皮肤中成纤维细胞的 mRNA 和蛋白表达水平,IHC 检测瘢痕疙瘩和正常皮肤中 KHIGs 蛋白水平。qRT-PCR 结果显示,KHIGs 在瘢痕疙瘩成纤维细胞样本中具有显著差异 (p 值≤ 0.05)(图8C) 和 LIF 表达在瘢痕疙瘩中上调。同时,PTGFR 和 RBP5 在瘢痕疙瘩中下调。Western blot(图8D 和 E)和 IHC 的 (图 .8F-K) 显示 PTGFR 和 RBP5 在蛋白水平 (p 值≤ 0.05) 验证了作者的结果,并且 LIE 表达较少,在蛋白水平上没有差异。
视黄酸的评价
作者使用 Enrichr 平台通过靶向可用于治疗或缓解瘢痕疙瘩的 KHIGs 来识别潜在药物。作者发现木犀草素 (LIF) (图 .9A)、视黄酸 (RBP5) (图9B) 和小白菊内酯 (PTGFR) (图 .9C) 紧密结合 (p 值 ≤ 0.05)。为分析三种药物的结合亲和力,采用 MMPBSA 方法计算药物和分子的结合自由能。结果表明,KHIGs 都能够与鉴定出的高结合能药物对接,如 LIF-木犀草素 (-7.1 kcal/mol)、RBP5-视黄酸 (-7.6 kcal/mol)、PTGFR-小白菊内酯 (-6.6 kcal/mol)。总之,表明这些药物可能会对瘢痕疙瘩的靶向治疗产生积极影响。探讨视黄酸在瘢痕疙瘩发病机制中的作用。首先,作者将用 10 μM TGF-β 1 处理 HSF 细胞 48 小时。作者发现 MF (ASPN、POSTN 和 COMP) 的 mRNA 表达上调 (p 值≤ 0.05),PIF 的 mRNA 表达 (APOE、CCL19 和 CXCL3) 下调 (p 值≤ 0.05) (图9D 和 E)。它们表明 TGF-β1 可以进一步增加正常皮肤成纤维细胞中 MF 的比例。然后,将 1μM 视黄酸加入 10 μM TGF-β 1 中并一起处理 48 小时。结果显示(图 9 )。10F-H) 中,1μM TGF-β5 组蛋白 RBP1 表达降低,I 型胶原与对照组相比显著升高。更有趣的是,在 TGF-β 5 中加入视黄酸后,作者发现视黄酸可以促进 RBP<> 表达的增加并抑制胶原蛋白 I 的产生。

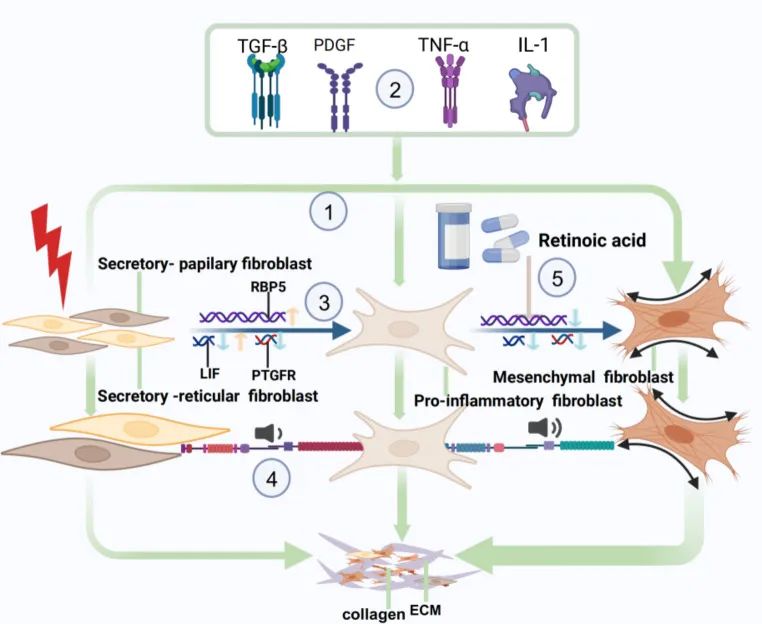
KHIGS 导致瘢痕疙瘩的潜在调节机制
为了揭示瘢痕疙瘩中 KHIGS 的机制,作者进一步整合了文献报告 [32, 40] 和作者的研究结果。作者绘制了 KHIG 在瘢痕疙瘩中的机制图:(1) 成纤维细胞分化轨迹:PIF、SPF 和 SRF 分化为 MF 的趋势。(2) TGF-β、TNF-α、PDGF 和 Wnt 信号通路在调节成纤维细胞功能中起关键作用。(3) KHIGs 在成纤维细胞分化位点的表达模式中也表现出时间异质性;即 LIF 先降低后升高,PTGFR 表达先降低后逐渐降低。RBP5 的表达先降低后升高。(4) SPF 和 SRF 细胞与 PIF 之间的通讯减少,而 PIF 和 MF 细胞之间的通讯增加。(5) 视黄酸通过促进 RB5 的表达进一步抑制 PIF 向 MF 的转化,从而减少胶原蛋白和细胞外基质 (ECM) 的产生(图 D)。10).
本研究使用多种生物信息学分析和机器学习算法为瘢痕疙瘩的诊断和治疗提供了新的免疫特征 (PTGFR、RBP5 和 LIF)。同时,通过分子对接方法和实验验证,将视黄酸确定为一种潜在的抗瘢痕疙瘩药物。有助于突破目前临床上诊断和治疗瘢痕疙瘩时遇到的困境。