选刊:大壮
整理:小帆,大壮
IF最新是9.6,学习一篇草稿箱里的稿子。研究使用深度学习实现了肺影响自动化分割和ARDS自动分类,适合模仿学习。
0.1 论文信息

0.2 期刊信息
0.3 研究背景
(1)急性呼吸窘迫综合征(ARDS)是一种在重症监护病房(ICU)中高发且致命的疾病。
(2)早期识别高危患者对及时干预和改善临床结果至关重要。由于ARDS复杂的病理生理机制,早期预测具有挑战性。
(3)研究利用深度学习技术对肺部CT图像进行自动分割,并预测急性呼吸窘迫综合征(ARDS)。
1 研究介绍
1.1 目的
(1)急性呼吸窘迫综合征(ARDS)在重症监护病房(ICU)住院患者中具有很高的发病率和死亡率。
(2)开发一种人工智能(AI)模型,用于自动肺病灶分割和ARDS的早期预测,以便在重症监护病房中及时进行干预。
1.2 方法
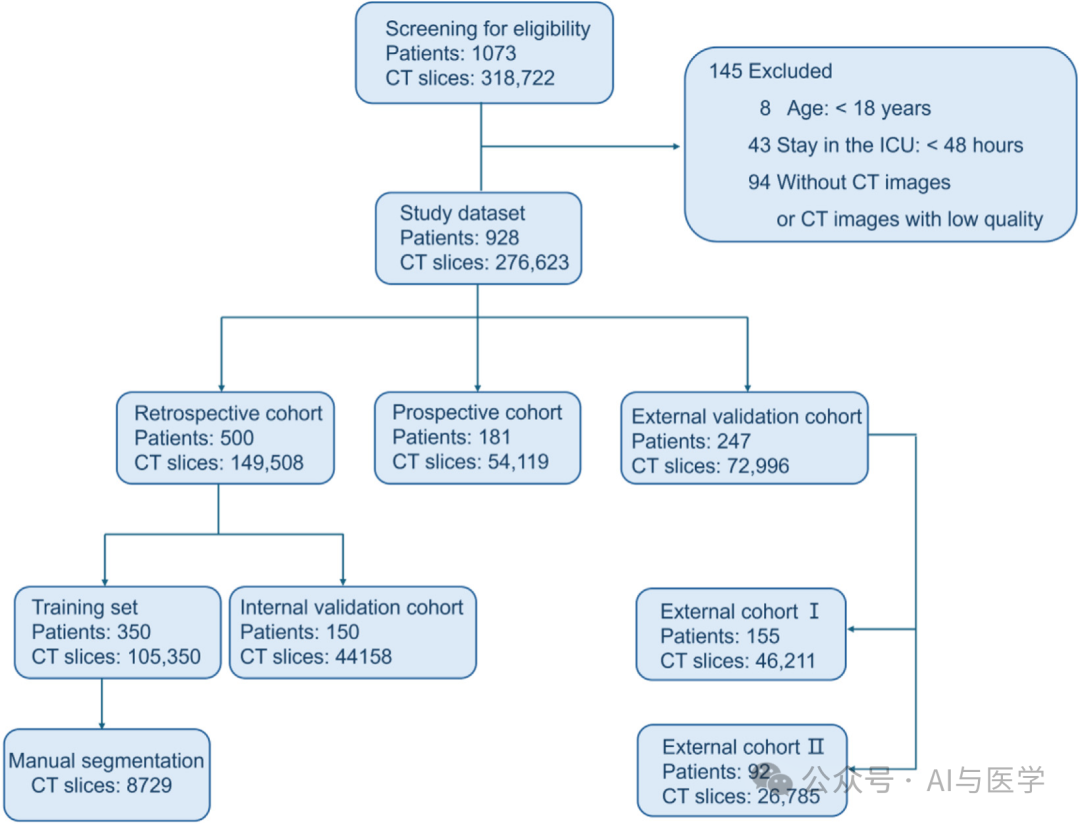
(1)本研究纳入了2018年11月至2021年11月期间在中国三家中心的共928名接受胸部计算机断层扫描(CT)检查的ICU患者。
(2)开发了一种基于深度学习的UNet Transformer(UNETR)模型框架。采用各种数据增强技术,使用医学开放网络人工智能(MONAI)框架。
(3)将深度学习框架的性能与基于Densenet的图像分类网络进行了比较,并在外部和前瞻性验证队列中进行了评估。
(4)分割性能通过Dice系数(DC)评估,预测性能通过接收者操作特性曲线下面积(AUC)、敏感性和特异性评估。
1.3 结果
(1)在验证集中,使用深度学习框架进行的分割任务达到了0.734 ± 0.137的DC。
(2)在预测任务中,基于深度学习的框架在内部验证队列、外部验证队列I、外部验证队列II和前瞻性验证队列中的AUC分别达到了0.916 [0.858–0.961]、0.865 [0.774–0.945]、0.901 [0.835–0.955]和0.876 [0.804–0.936]。
(3)在预测准确性方面,它优于基于Densenet的图像分类网络。
(4)ARDS预测模型识别出肺病灶特征和临床参数(如C反应蛋白、白蛋白、胆红素、血小板计数和年龄)是ARDS预测的重要贡献因素。
2 数据介绍
2.1 数据信息
(1)本多中心队列研究包括了来自三家医院重症监护病房(ICU)的928名患者。在整体患者群体中,ARDS(急性呼吸窘迫综合症)的发生率为29.5%(274/928)。
(2)纳入标准(符合任一即可)
(3)排除标准:
年龄小于18岁;
ICU住院时间少于48小时;
无CT图像或CT图像质量低下。
(4)数据来源
①回顾性队列
②前瞻性队列
从医疗中心1收集了181名患者【发生率为27.6%(50/181)】和54,119张CT切片的信息,用于前瞻性验证。
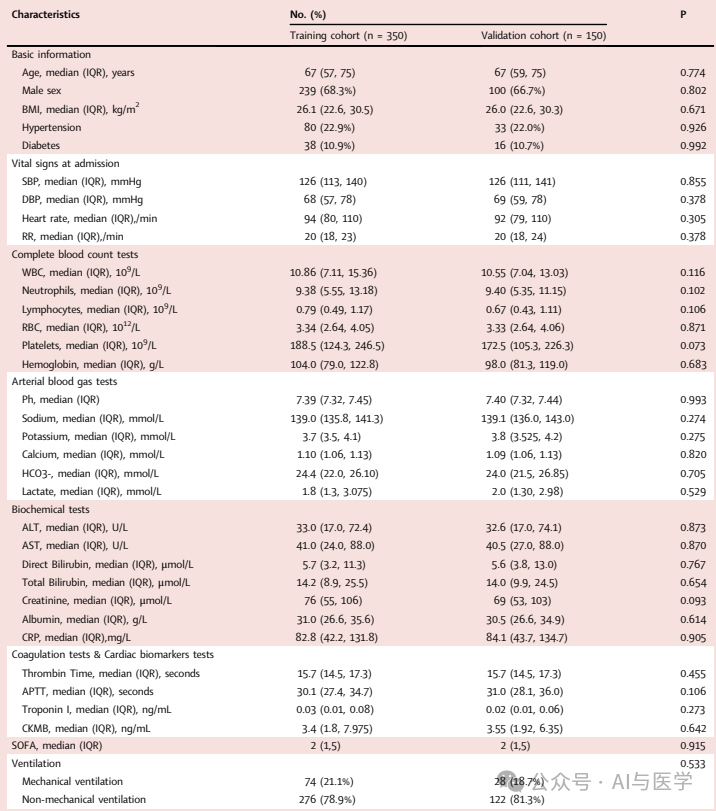
训练组和内部验证组患者的基线特征
2.2 方法细节
(1)ARDS的诊断
研究内容:急性症状发作、胸部影像出现双侧浸润未完全解释为积液、肺叶/肺萎陷或结节、呼吸衰竭未完全归因于心脏衰竭或液体超负荷、PaO2/FiO2比值≤300 mmHg,PEEP至少为5 cm H2O。
(2)成像预处理与CT图像手动分割
(3)自动化肺部CT分割框架
(4)肺部CT分类网络
(5)ARDS预测模型与数据整合及解释
模型开发与比较(7种):逻辑回归(LR)、K近邻算法(KNN)、高斯朴素贝叶斯(GNB)、随机森林(RF)、极端梯度提升(XGB)、AdaBoost(ADB)和梯度提升决策树(GBDT),以预测ARDS。
肺部病变分割与3D重建:开发肺部病变分割模型,并对分割CT图像进行了3D重建
病变参数计算与数据整合:计算病变参数,将病变数据与患者的临床信息和实验室检查结果整合在一起。
模型性能评估:评估七种机器学习模型的性能,确定预测ARDS的最佳准确度模型。
结果可解释性:使用Shapley解释图可视化
3 结果
3.1 自动化肺部病变分割模型的评估
(1)自动化肺部CT分割模型在25,000次迭代中训练损失逐渐下降,表明学习过程逐步进行并趋于收敛。
(2)在测试集中,自动化分割模型的DC为0.734,表明在病变边界描绘方面相较于人类专家具有较高的准确性。
(3)肺野、磨玻璃密度、实变、肺纤维化和胸腔积液的DC值分别为:0.967 ± 0.098,0.741 ± 0.131,0.756 ± 0.157,0.629 ± 0.018,和0.701 ± 0.201。
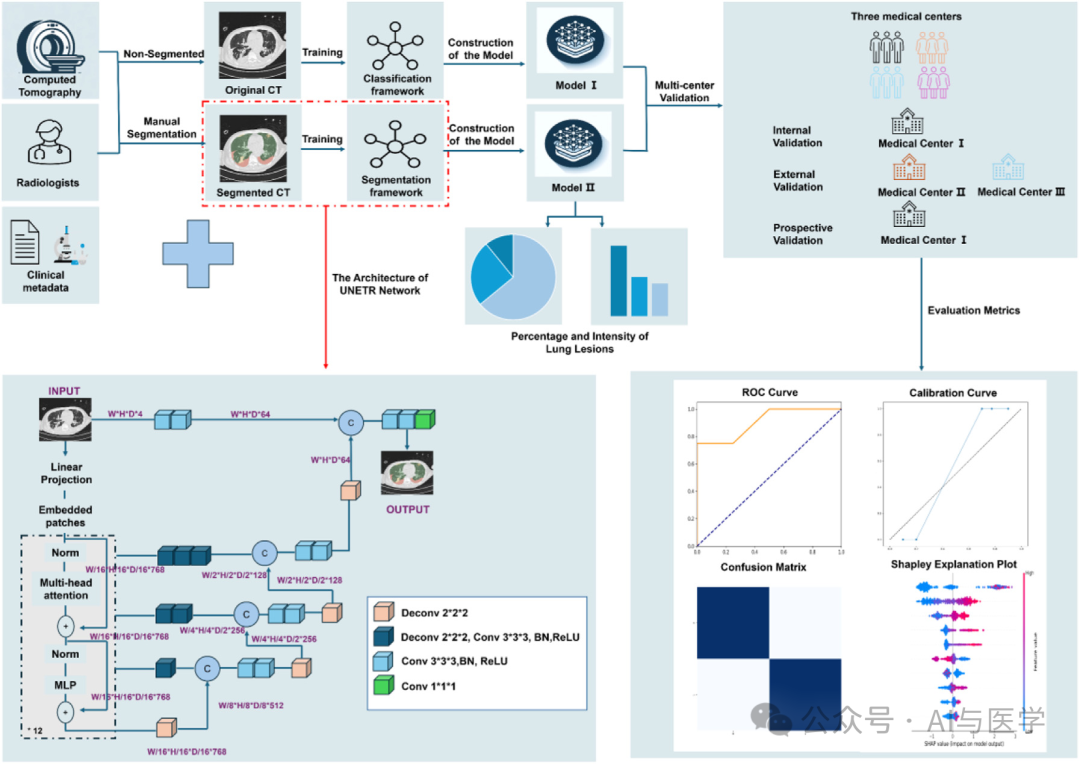
ARDS预测自动化AI分析框架
3.2 使用量化的肺部病变参数和临床数据预测ARDS
(1)在仅使用肺部病变参数的模型中,XGB模型表现最佳,AUC为0.860,95%置信区间(CI)为0.783–0.930。
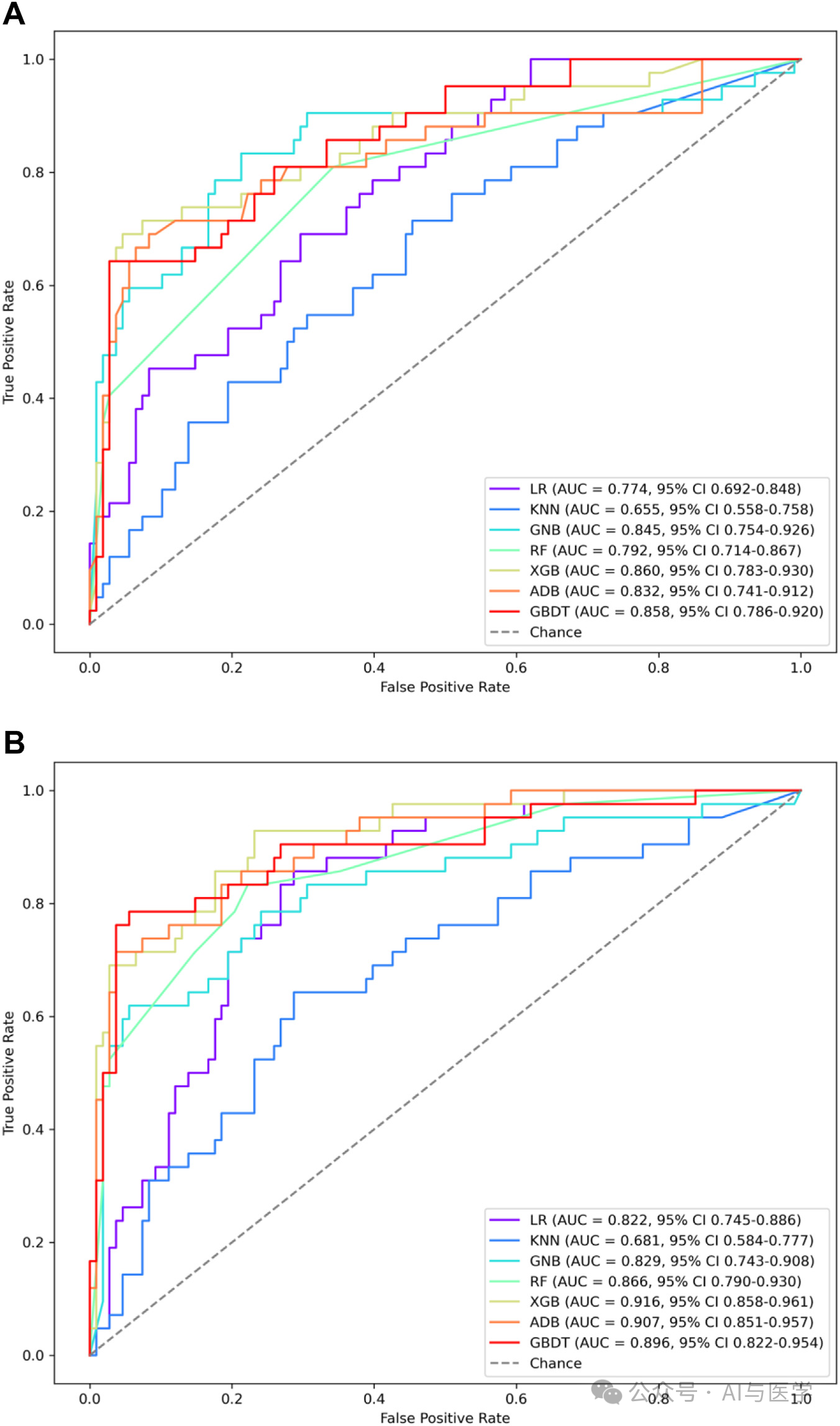
(2)在综合数据的模型中,XGB模型的表现更为优越,AUC为0.916,95% CI为0.858–0.961。

(3)将一般临床信息和实验室测试结果纳入机器学习训练数据集中,可以显著提高ARDS模型的整体预测性能。
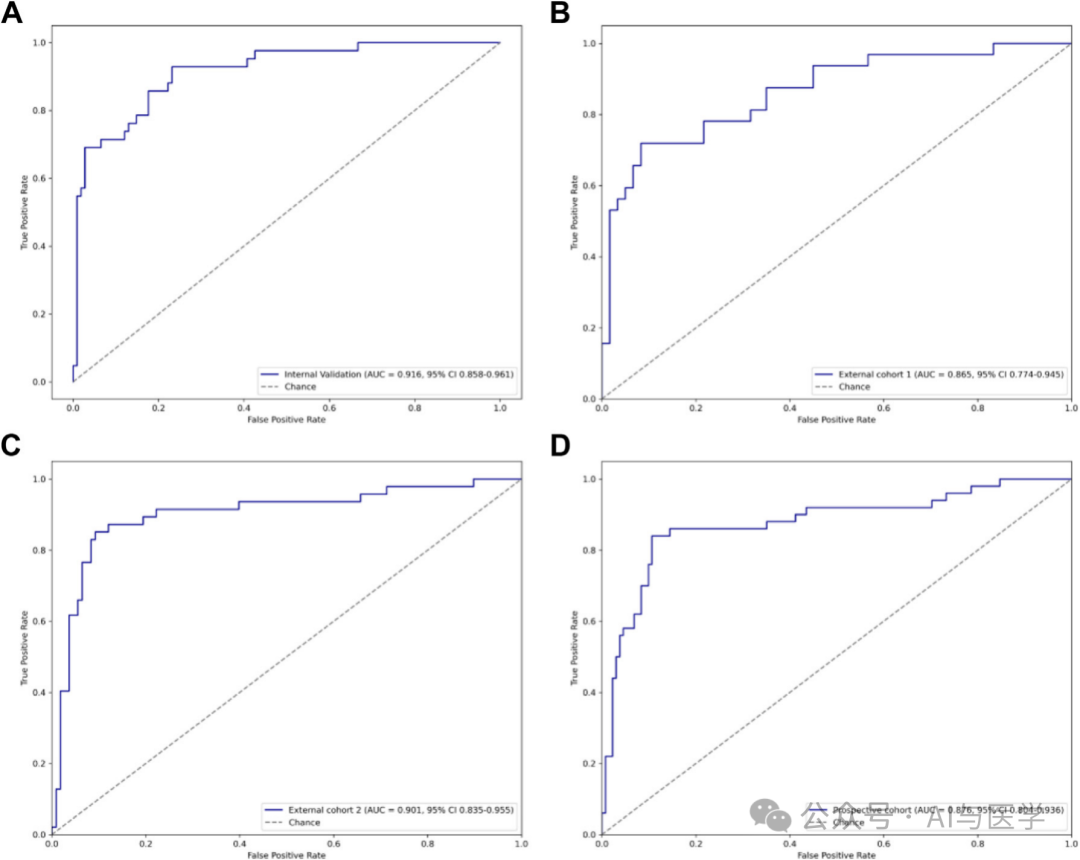
3.3 ARDS预测模型的外部和前瞻性验证
(1)该模型在所有验证队列中均表现出强劲的性能。
(2)内部验证队列:AUC为0.916,95% CI为0.858–0.961。
外部验证队列I:AUC为0.865,95% CI为0.774–0.945。
外部验证队列II:AUC为0.901,95% CI为0.835–0.955。
前瞻性验证队列:AUC为0.876,95% CI为0.804–0.936。
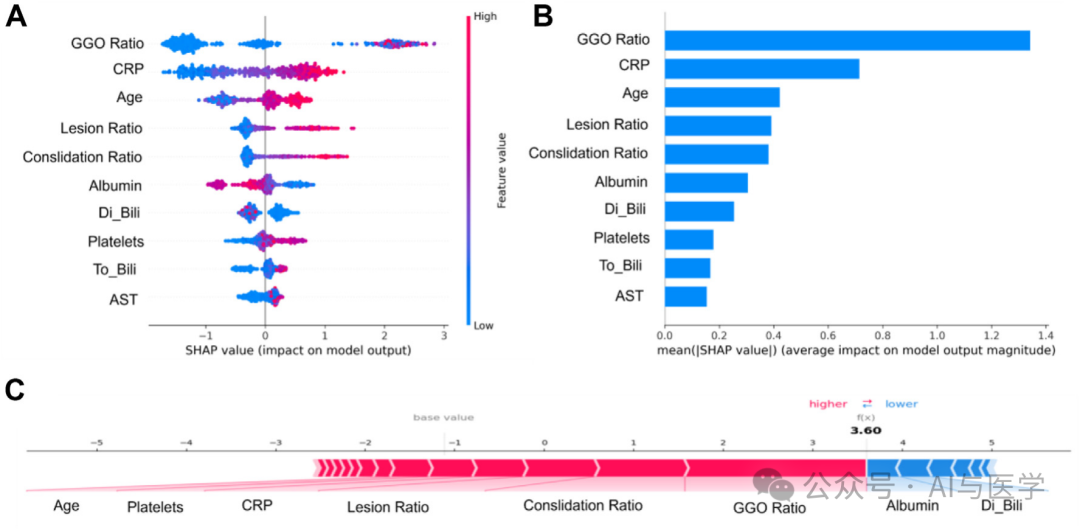
3.4 ARDS预测模型的图形解释
(1)病变特征是ARDS预测的重要贡献因素。
(2)几个临床参数(如C反应蛋白(CRP)、白蛋白、胆红素、血小板计数和天冬氨酸转氨酶(AST)水平)及一般临床特征(如年龄)也在ARDS预测中发挥了重要作用。
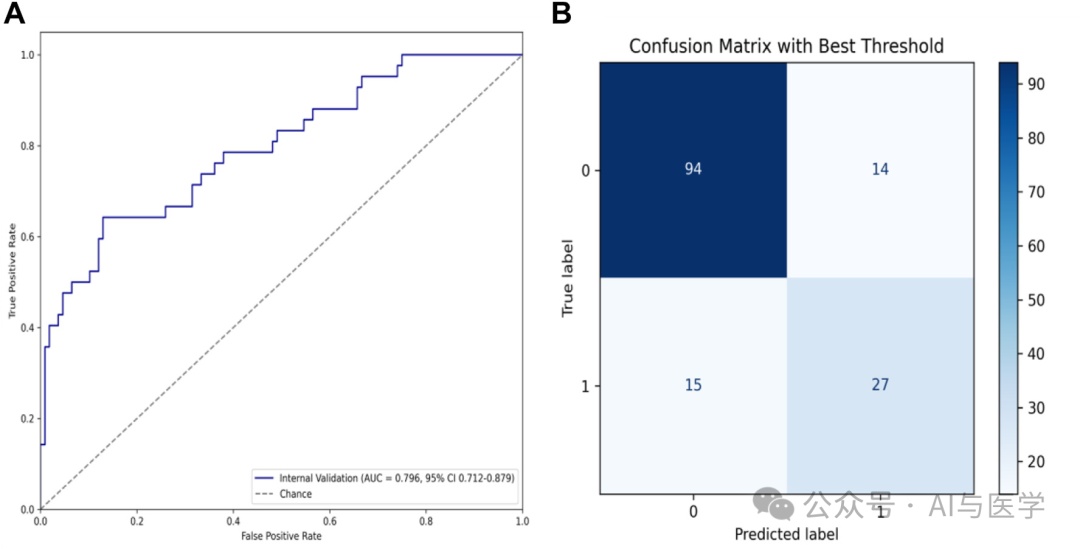
3.5 基于Densenet的CT图像分类网络性能
(2)在内部验证集中,CT图像分类网络实现了0.796的AUC,95% CI为0.712–0.879。
(3)混淆矩阵显示了良好的预测能力,但其性能明显低于基于综合患者临床信息和实验室测试结果的ARDS预测模型。
(4)通过DeLong检验,比较了Densenet模型和XGBoost模型的AUC值,P值为0.002,表明两模型的性能存在统计学上的显著差异。
4 学习心得
(1)基于深度学习的AI模型,在自动化肺部CT图像分割和ARDS早期预测方面显示出了卓越的准确性和鲁棒性。
(2)未来的研究应关注通过联邦学习集成多中心数据,并将模型部署在边缘计算设备上,以增强其在实际应用中的适用性并改善ICU患者的预后
引用
[1]Zhou Y, Mei S, Wang J, et al. Development and validation of a deep learning-based framework for automated lung CT segmentation and acute respiratory distress syndrome prediction: a multicenter cohort study[J]. eClinicalMedicine, 2024, 75.
感谢您的阅读,如果您对这项研究感兴趣或想了解更多关于AI在医学中的应用,请继续关注我们,我们会定期分享最新的科研成果和健康资讯。别忘了点赞和转发哦!👍🔄