
今天给同学们分享一篇生信文章“Identification of hypoxia- and immune-related biomarkers in patients with ischemic stroke”,这篇文章发表在Heliyon期刊上,影响因子为4。

结果:
为了探索IS和正常状态之间基因表达差异的程度,作者挖掘了差异表达基因(DEGs)。总共筛选出4171个IS组和对照组之间的DEGs,其中包括1645个上调基因和2526个下调基因(图1A)。热图显示了前15个上调和下调的DEGs(图1B)。在200个缺氧相关基因和4171个DEGs的交集中,获得了45个DEHRGs,用于后续分析(图1C)。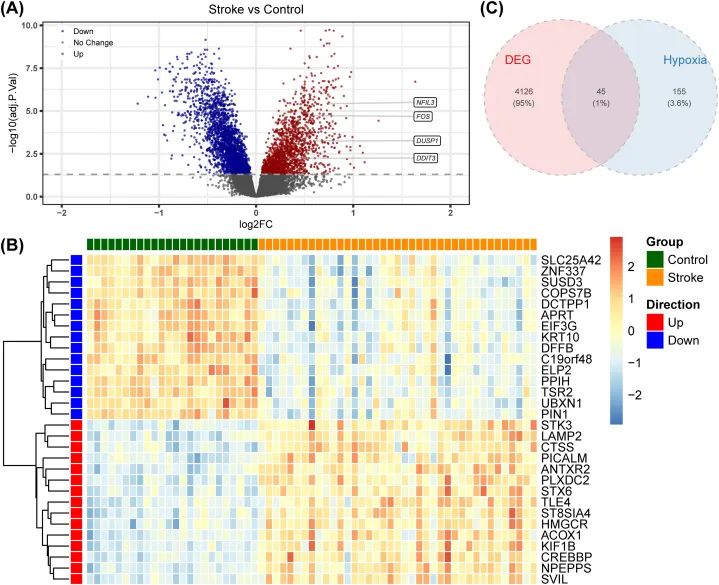
免疫浸润细胞分析
由于一项现有研究专注于调查胶质细胞介导的免疫反应在IS发病机制中的作用,作者首先通过免疫浸润分析探索了AD和正常样本之间的免疫细胞浸润差异。为了获得IS和对照样本之间的差异性免疫细胞,作者将28种免疫浸润细胞的富集比例绘制成热图,如图2A所示。图2B的结果显示,IS和对照样本之间的激活CD8 T细胞、激活B细胞、CD56dim自然杀伤细胞、激活树突状细胞、效应记忆CD8 T细胞、中央记忆CD8 T细胞、自然杀伤细胞、γδ T细胞、中性粒细胞和浆细胞样树突状细胞的丰度存在显著差异(adj.p < 0.05)。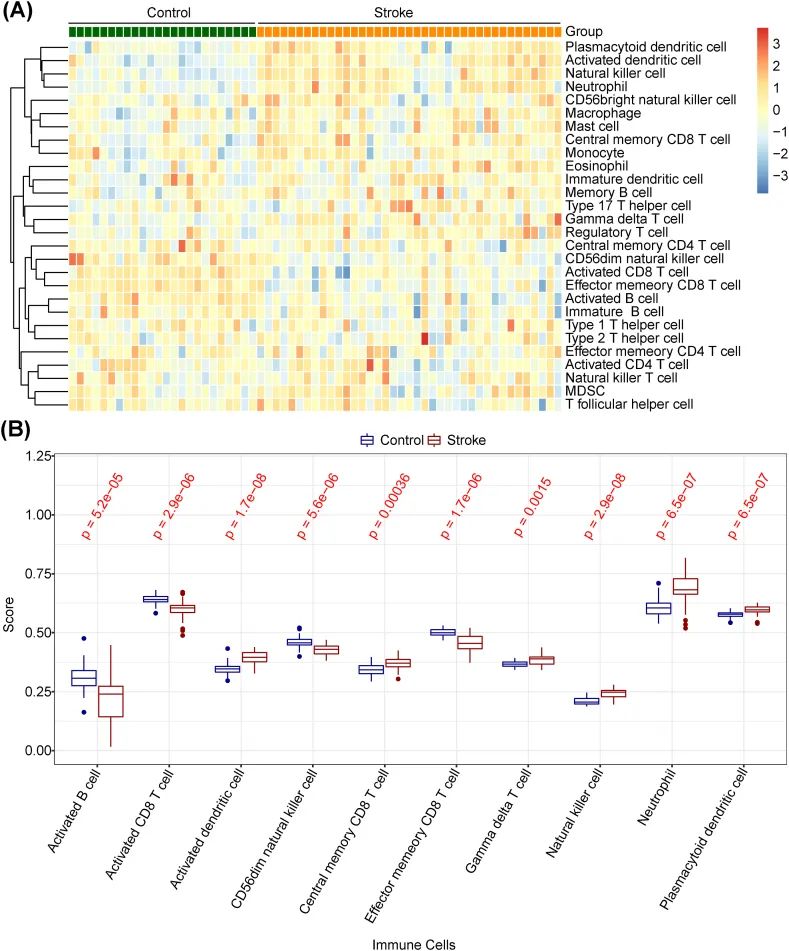
上述差异性免疫细胞被用作通过WGCNA识别免疫相关基因的临床特征。首先,使用表达式的欧氏距离对GSE16561数据集中的样本进行聚类,以检查是否存在异常值。图3A显示存在一个异常样本。在去除异常值后,对剩余样本进行聚类,其中绿色为对照样本,橙色为IS样本。接下来,当软阈值(power)为4时,R2为0.85,这意味着连接性趋向于0(图3C)。然后,通过动态树切割算法确定了共表达网络中的17个模块(图3D)。根据图3E中的模块-特征关系,作者选择了六个相关系数大于0.6的模块(棕色、黄色、绿色、粉色、鲑色和红色)进行进一步分析。总共鉴定出了六个模块中的5426个免疫相关基因,用于后续分析。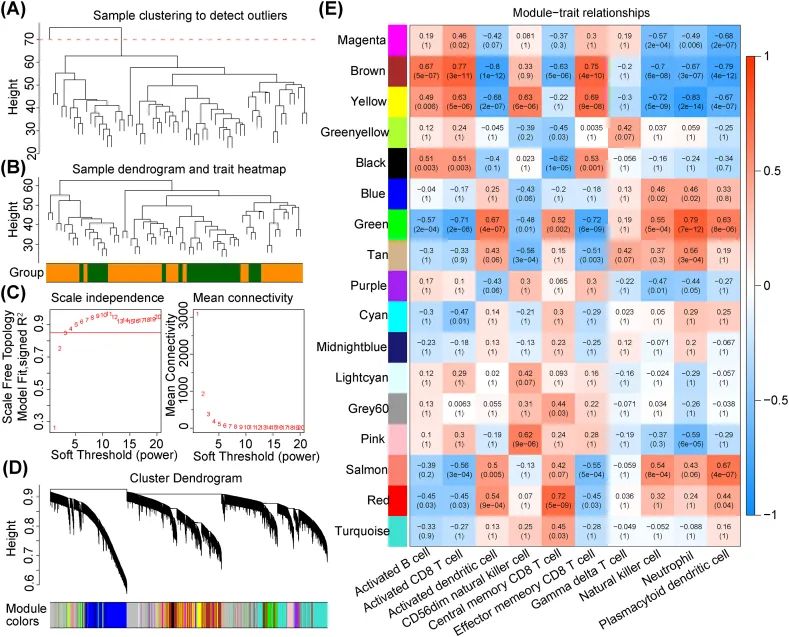
然后,作者对上述模块中的45个DEHRGs和5426个基因进行了交集运算,从而确定了27个与免疫相关的DEHRGs(图4A)。作者进行了GO和KEGG富集分析,以研究这些与免疫相关的DEHRGs的潜在功能。如图4B所示,GO分析显示,与免疫相关的DEHRGs主要富集在对缺氧的反应、细胞多糖代谢过程、对氧气水平降低的反应以及多糖代谢过程中。如图4C所示,KEGG富集分析指出这些DEHRGs显著涉及脂质和动脉粥样硬化,以及HIF-1信号通路。因此,作者推测这27个与免疫相关的DEHRGs可能通过上述途径参与IS的发生和发展。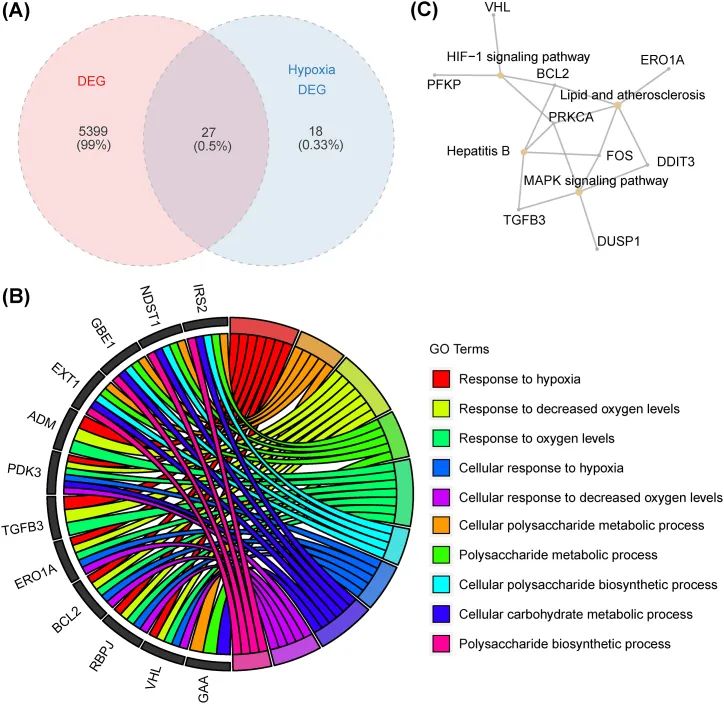
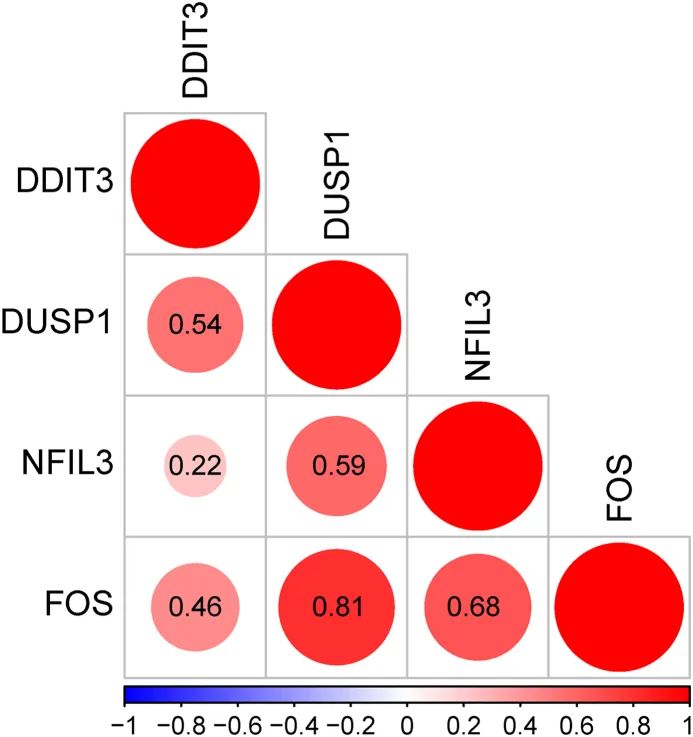
为了探索免疫相关的DEHRGs之间的相互作用,使用STRING数据库建立了PPI网络,在该网络中除了PLAC8、RPAGD、HDLBP和MYH9之外的基因之间存在复杂的相互作用(图5A)。随后,将上述PPI网络导入Cytoscape软件,并使用MCODE插件选择核心模块以过滤出中心基因。总共确定了四个中心基因(FOS、DDIT3、DUSP1和NFIL3),用于后续分析(图5B)。中心基因的度在图5C中显示。功能相似性研究结果显示,FOS具有最高的功能相似性得分(图6)。相关性结果表明,DUSP1和FOS之间具有最强的正相关性(r = 0.81;图7)。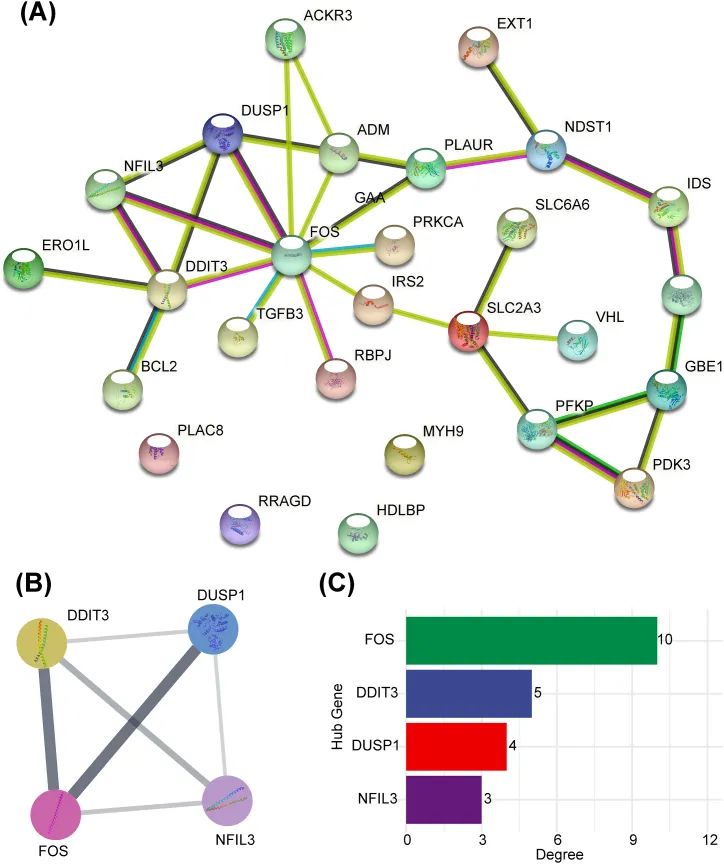
为了确定浸润免疫细胞与中心基因之间的关系,作者进行了相关性分析。根据研究结果,DDIT3与嗜酸性粒细胞之间存在最强的正相关关系;而DUSP1、FOS和NFIL3与中性粒细胞之间存在最强的正相关关系。此外,DDIT3、DUSP1、FOS和NFIL3与效应记忆CD8 T细胞之间存在最强的负相关关系(图8)。综合以上免疫浸润分析的结果,作者推测中性粒细胞和效应记忆CD8 T细胞在IS的发生和发展中起到了一定作用,并且这可能与中心基因有关。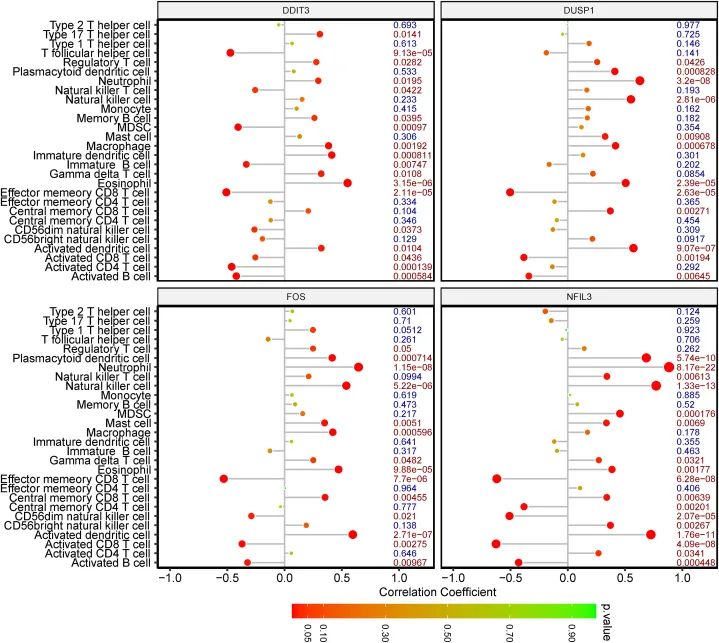
GSEA被用于研究IS中枢基因的作用(图9)。DUSP1、FOS和NFIL3高表达组的基因在FC gamma R介导的吞噬作用和趋化因子信号通路中均高度富集。DDIT3高表达组的基因在补体和凝血级联反应、泛酸和辅酶A生物合成中显著富集。DUSP1、FOS和NFIL3低表达组的基因主要富集在氧化磷酸化和帕金森病中。DDIT3低表达组的基因在移植排斥和氨酰tRNA生物合成中高度富集。此外,DUSP1与MAPK信号通路之间存在强大的关联。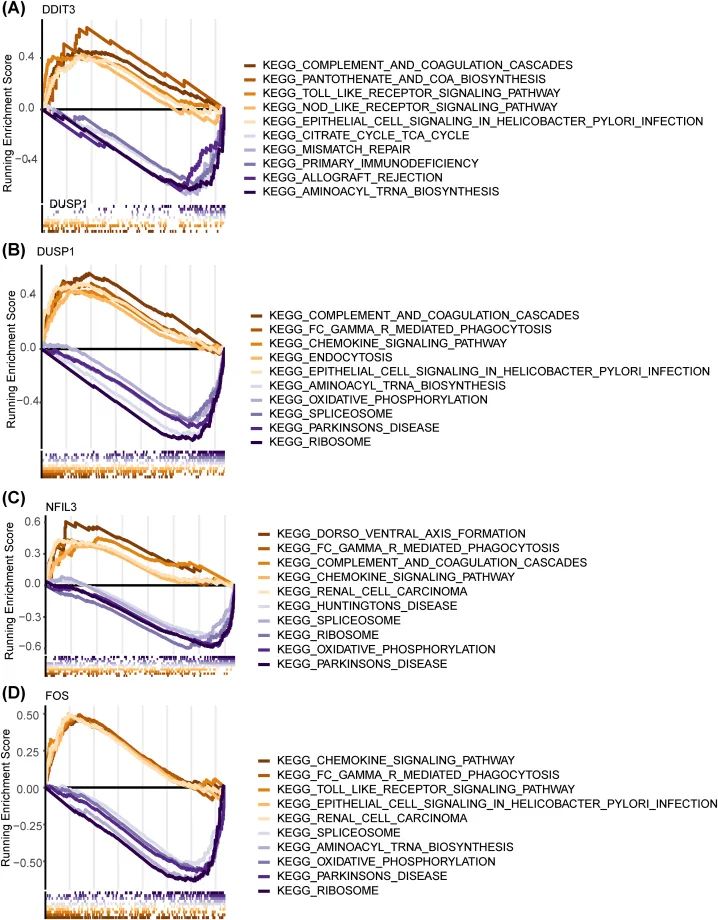
对于IS患者的治疗,使用DGIdb确定了39种潜在药物(附表1),如阿司匹林、舒拉明、尼莫地平、塞来昔布、环孢素、维生素E、去铁胺、姜黄素和大豆黄酮。在本研究中,发现26种药物与DDIT3相互作用,10种药物与FOS相互作用,3种药物与DUSP1相互作用。不幸的是,在该数据库中作者无法找到任何可能特异性靶向NFIL3的小分子药物。此外,使用Cytoscape创建了药物-基因网络,其中紫杉醇可以作用于FOS和DDIT3(图10)。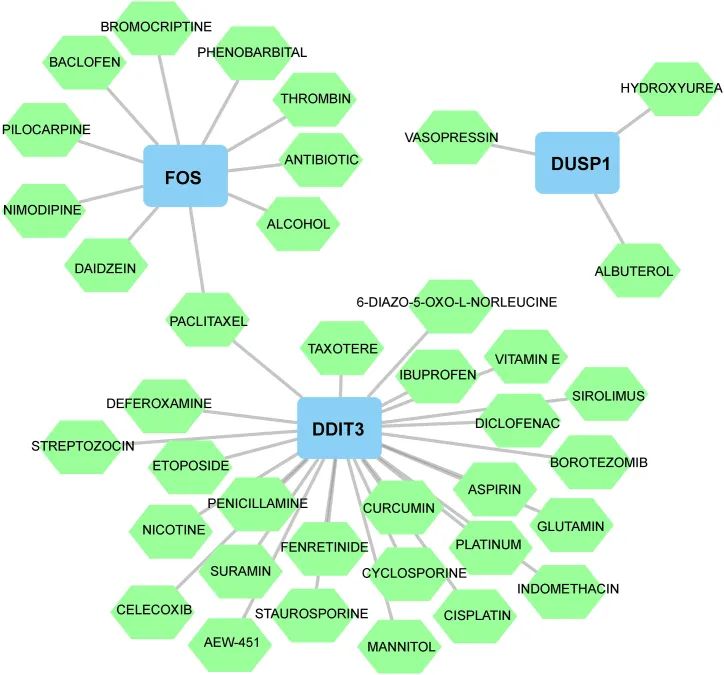
为了研究中心基因的潜在调控机制,作者进行了针对中心基因的转录因子(TFs)和miRNA的预测。图11展示了一个包含36个转录因子(如YY1、ESR1、ELK1、FOXC1和SREBF2)、4个中心基因和278个miRNA(如miR-32-3p、miR-195-5p、miR-148b-3p和miR-128-3p)的相互作用网络。作者使用Cytoscape构建了一个miRNA-中心基因-TF调控网络,以了解中心基因的可能转录调控机制(见图11)。FOS是受最多miRNA调控的中心基因(受105个miRNA调控),也是受最多转录因子调控的中心基因(受11个转录因子调控)。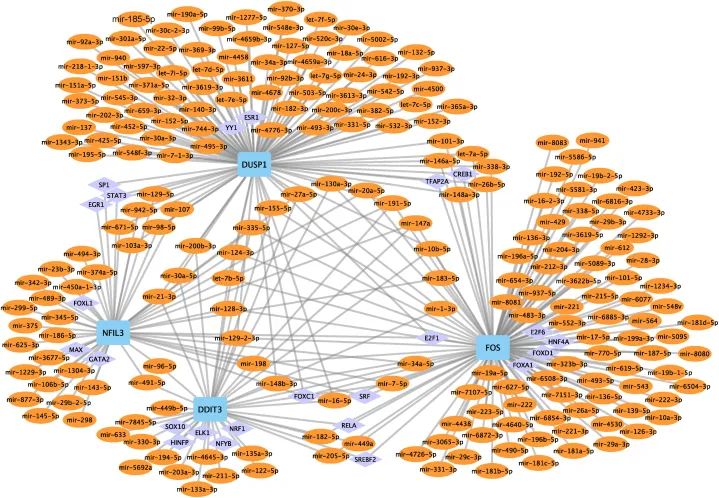
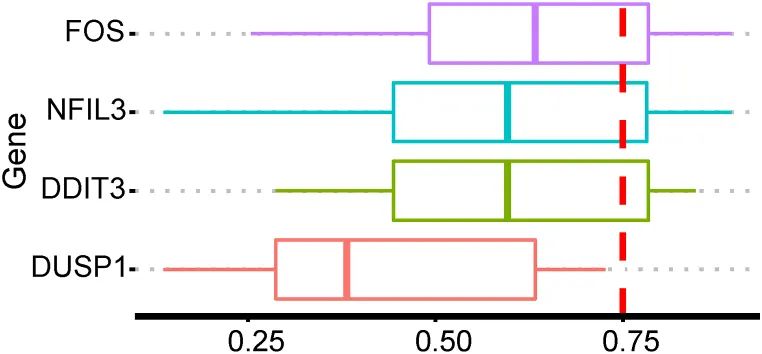
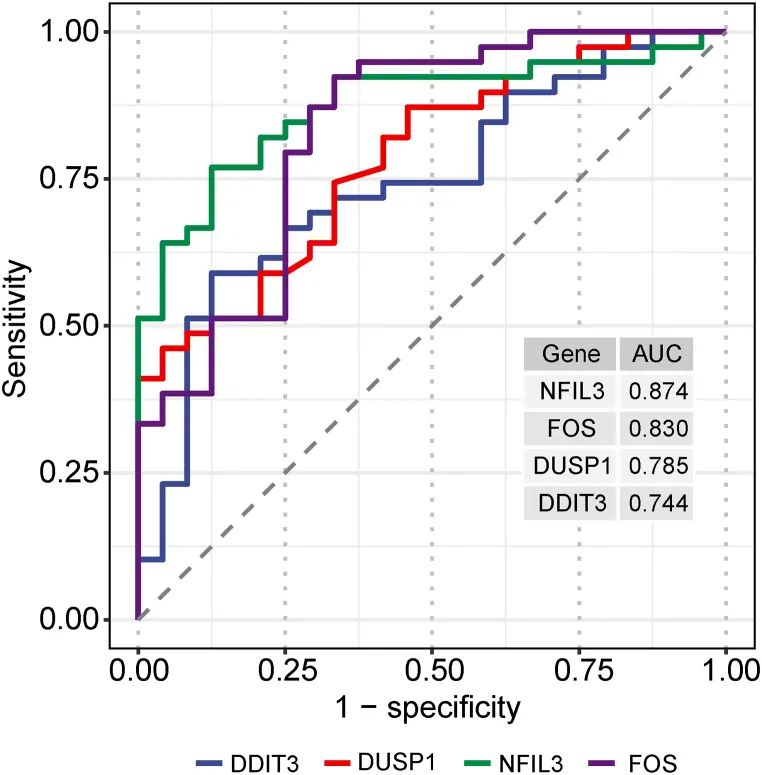
作者观察到在IS样本中,中心基因的表达水平明显增加,与对照组相比(图12)。如图13所示,FOS、DDIT3、DUSP1和NFIL3的AUC值分别为0.830、0.744、0.785和0.874,表明这些中心基因具有良好的诊断价值。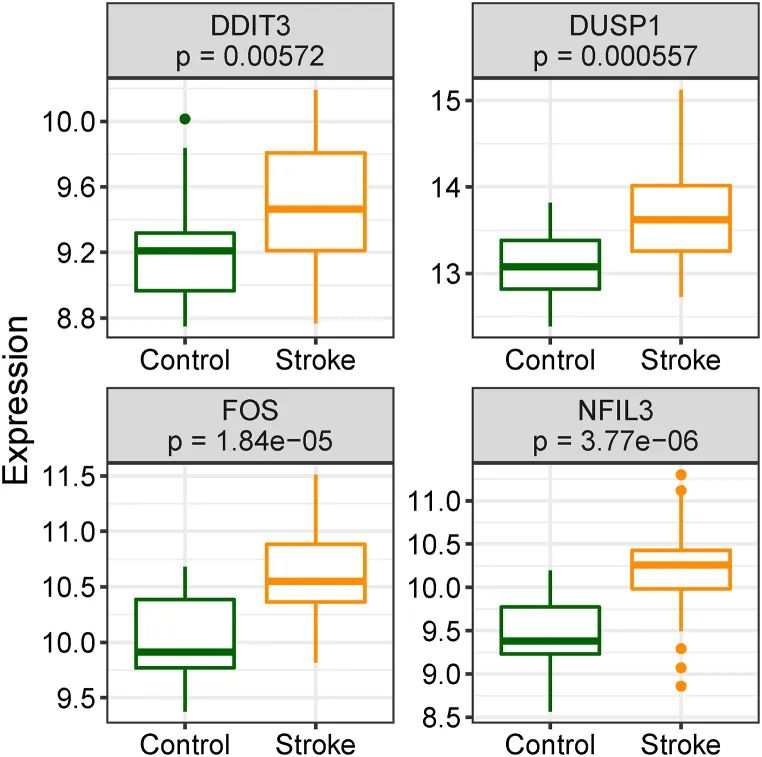
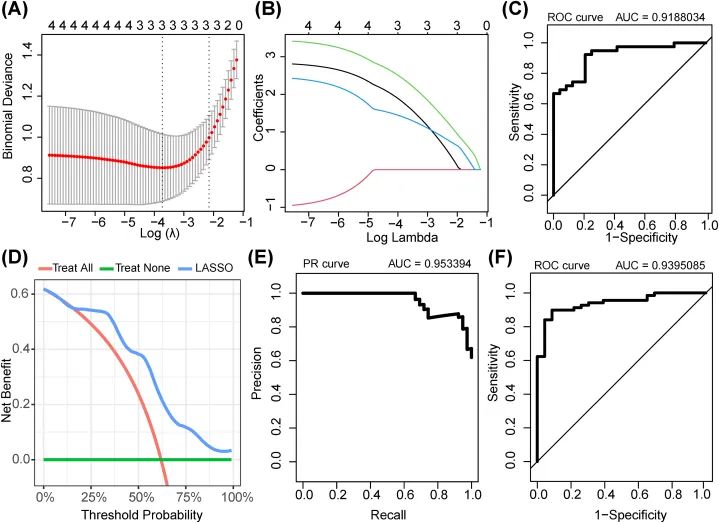
基于参与 IS 的免疫相关基因建立的 LASSO 诊断模型
随后,使用 LASSO 算法进一步筛选 IS 的基因标记(DDIT3、NFIL3 和 FOS)从中心基因中(图 14A 和 B)。因此,作者构建了一个基于 DDIT3、NFIL3 和 FOS 的 LASSO 诊断模型,ROC 曲线表明该模型具有高准确性(AUC = 0.9188034;图 14C)。PR 和 DCA 曲线进一步表明该模型具有良好的性能(图 14D 和 E)。此外,作者在外部数据集(GSE58294)上测试了 LASSO 诊断模型。ROC 曲线验证了它保持了较高的诊断准确性(AUC = 0.9395085;图 14F)。与其他模型(例如,免疫基因相关模型)相比,先前描述的神经网络诊断模型在训练集中的 AUC 值为 0.909,在验证集中为 0.835 [34]。因此,本研究构建的免疫相关 DEHRG 相关模型表现更好。
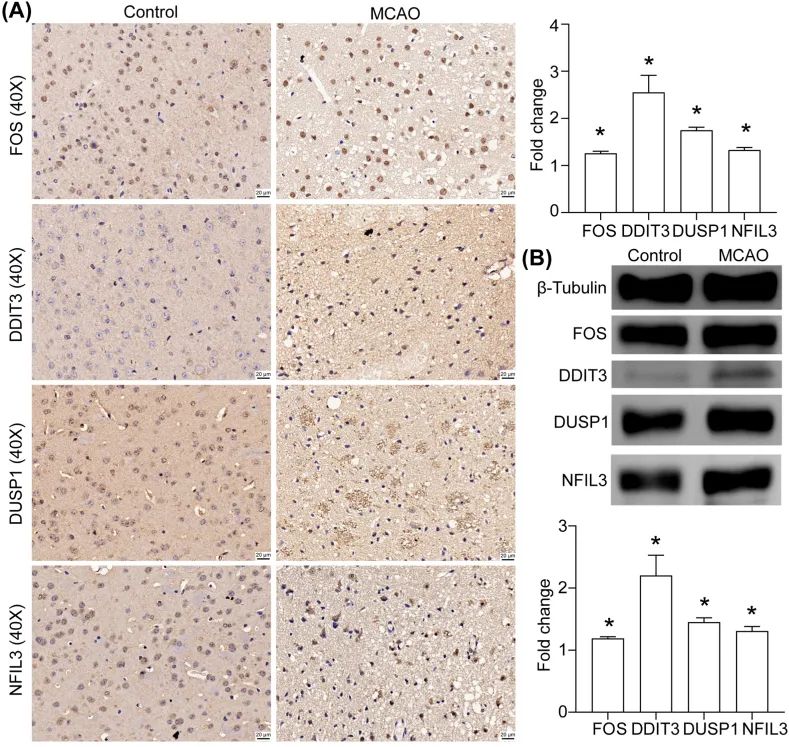
缺血后脑组织中 FOS、DDIT3、DUSP1 和 NFIL3 的表达验证
使用小鼠 MCAO 模型构建脑缺血环境。取脑缺血瘢痕组织进行免疫组化染色和 Western blotting,检测缺血后 FOS、DDIT3、DUSP1 和 NFIL3 的表达。结果显示,表达增加,与作者从数据库分析得到的结果一致(图 15A 和 B)。
简而言之,作者确定并验证了四个关键基因——FOS、DDIT3、DUSP1 和 NFIL3,这些基因可能参与了 IS 的病理发展,为 IS 的诊断和治疗提供了新的视角。
往期推荐