在妇科恶性肿瘤中,HGSOC是最具侵袭性的一种,其发病率和死亡率均居高不下。尽管铂类药物化疗是治疗HGSOC的标准方案之一,但患者对这种治疗的反应存在显著差异。目前,临床上缺乏可靠的生物标志物来预测患者对铂类药物的敏感性,从而影响治疗效果和预后。这一挑战不仅影响治疗效果,也关系到患者的预后和生活质量。随着人工智能和深度学习技术的飞速发展,基于病理图像的自动化分析方法为肿瘤研究带来了新的希望。特别是多实例学习(MIL)模型,它能够处理大规模病理图像数据,为多种肿瘤类型的预测和分类研究提供了新工具。然而,将这一技术应用于HGSOC患者铂类药物反应预测的研究尚处于起步阶段。本文介绍了一项突破性的研究,旨在开发一个名为PathoRiCH的基于病理图像的深度学习分类器。
本研究旨在开发一个基于病理图像的深度学习分类器——PathoRiCH,通过多实例学习模型分析病理图像,预测HGSOC患者对铂类药物的反应。我们使用了来自三个独立患者队列的大规模数据进行模型训练和验证,以期提高对铂类药物敏感性预测的准确性,从而为个体化治疗提供新的思路和方法。
该研究不仅有助于理解HGSOC对铂类药物反应的潜在机制,还为开发新型预测工具和个体化治疗策略奠定了基础。通过整合分子标志物和病理图像信息,我们希望能够实现更精确的患者分层,提高治疗效果和患者生存率。
本研究的数据来源于三个独立的患者队列,包括SEV、TCGA和SMC队列。总计814名高等级浆液性卵巢癌(HGSOC)患者的病理图像被用于模型训练和验证。
为了确保图像质量和一致性,我们使用了标准的病理图像预处理步骤。首先,对全切片图像进行数字化处理,并根据肿瘤区域进行分割。然后,使用不同放大倍率(5倍和20倍)对图像进行处理,以捕捉不同层次的细节。
我们采用多实例学习(MIL)模型,通过分析多个图像实例来预测患者对铂类药物的反应。具体步骤如下:
图像分割:将每张病理图像分割成多个小片段(patches)。
特征提取:使用卷积神经网络(CNN)从每个片段中提取特征。
实例聚合:将提取的特征进行聚合,形成一个全局特征向量。
分类预测:利用全局特征向量,通过全连接层进行分类,预测患者的铂类药物反应情况。
模型的训练和验证分别在内部和外部进行:
内部验证(SEV队列):使用SEV队列中的图像进行训练和初步验证。
外部验证(TCGA和SMC队列):在训练好的模型上,使用TCGA和SMC队列中的图像进行独立验证,以评估模型的泛化能力。
为了优化模型性能,我们评估了六种不同的MIL模型,比较了全组织区域和癌症分割区域在不同放大倍率下的效果。最终选择了表现最佳的模型进行进一步分析。
为了提高预测的准确性,我们将PathoRiCH模型的预测结果与BRCA基因突变状态和同源重组缺陷(HRD)状态相结合。通过这种方法,我们进一步优化了对铂类药物反应的预测能力。
使用Kaplan-Meier生存分析和Cox回归模型评估模型的预测性能。通过生存曲线和风险比(HR)对不同预测组别进行对比,验证模型的有效性。
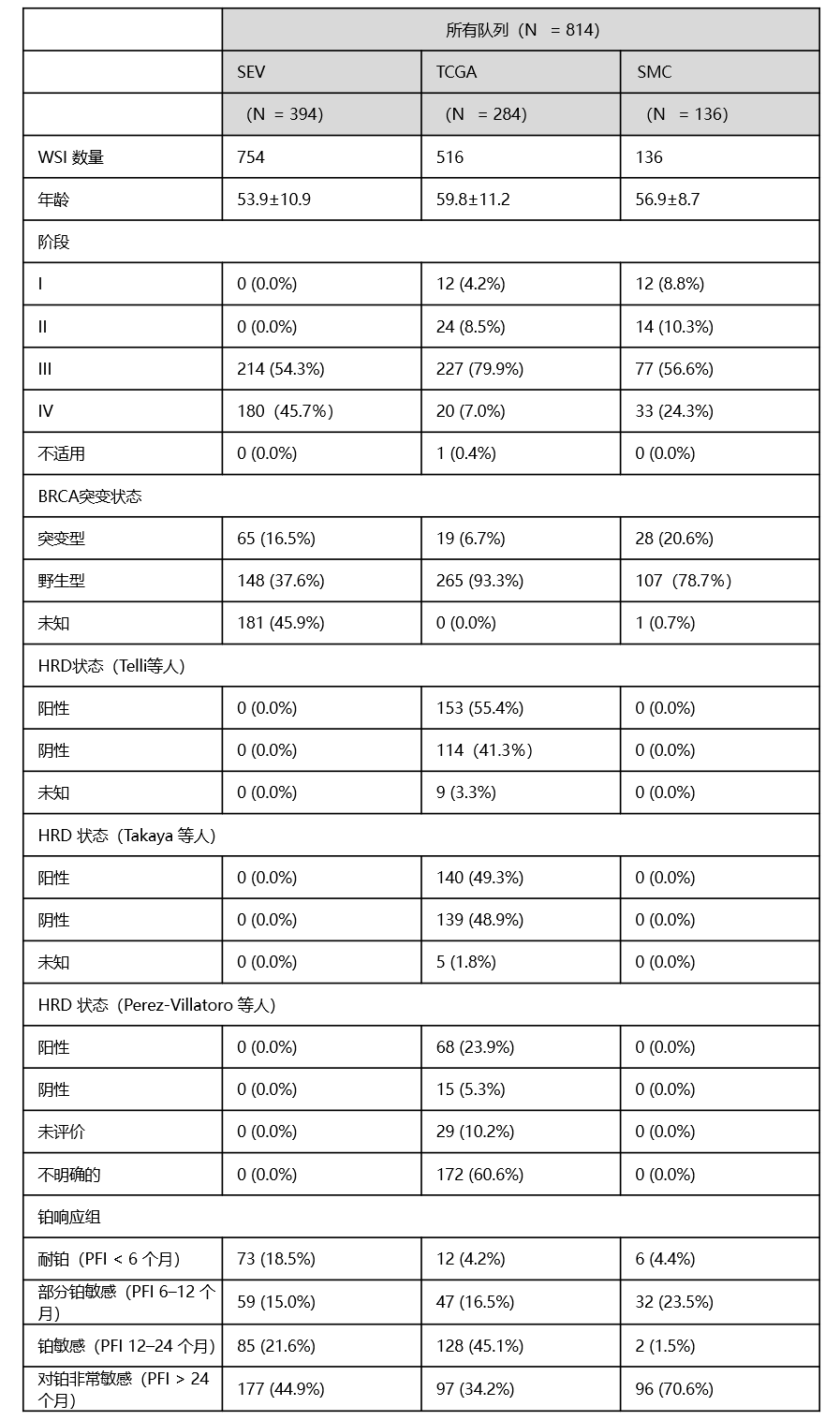
我们分析了814名HGSOC患者的病理图像数据:其中394名患者来自延世塞弗兰斯医院(SEV队列),284名患者来自癌症基因组图谱卵巢癌(TCGA-OV)数据库(TCGA队列),136名患者来自三星医疗中心(SMC队列)。患者根据无铂间隔(PFI)被分为四组:铂类耐药(PFI ≤ 6个月)、部分铂类敏感(PFI 6-12个月)、铂类敏感(PFI 12-24个月)和高度铂类敏感(PFI > 24个月)。为了预测对铂类治疗的反应,我们使用12个月的截止值,将“铂类耐药”和“部分铂类敏感”患者归为反应差组,“铂类敏感”和“高度铂类敏感”患者归为有利反应组。对于BRCA突变和HRD状态的预测,评估了有可用BRCA突变或HRD状态结果的患者(分别为n = 767和n = 284)。
表1 高级别浆液性卵巢癌所有队列的患者特征
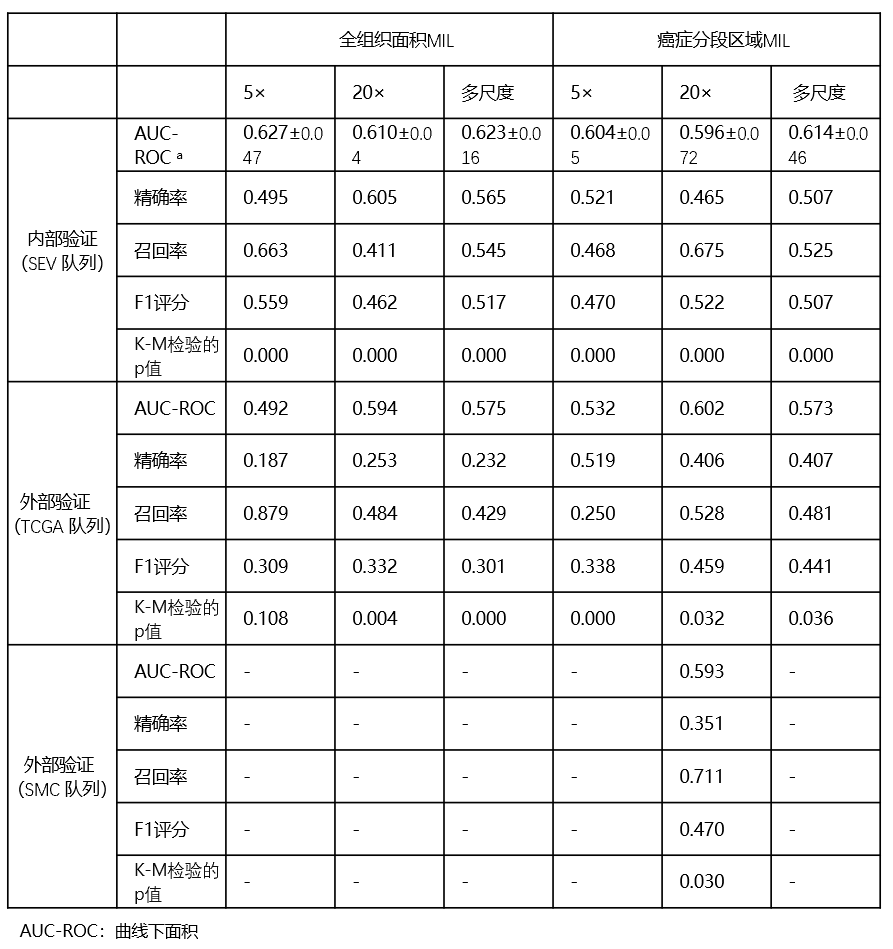
我们研究了六种不同的MIL模型,使用了两个图像区域(全组织和癌症分割区域)和三种放大倍数(5倍、20倍以及5倍和20倍的组合)。图1显示了所提出的MIL模型的概述。对于全组织和癌症分割区域模型,分别训练了17,742,605和3,822,597个块。图像放大倍数设置基于常用的病理诊断方法:低放大倍数(5倍)用于结构级别评估,高放大倍数(20倍)用于细胞级别评估,多尺度级别用于整合来自5倍和20倍图像的信息。
 图1 多实例学习模型概述
图1 多实例学习模型概述
SEV队列的五倍交叉验证用于培训和内部验证。在内部(SEV)验证中,全组织区域MIL通常表现出比癌症分割区域MIL更好的性能(表2)。具体而言,全组织区域5倍放大模型表现出最佳性能,受试者工作特征曲线下平均面积(AUC-ROC)值为0.627。然而,在外部(TCGA)验证中,癌症分割区域20倍放大模型表现出最佳性能,AUC-ROC值为0.602,5倍模型的性能在全组织和放大倍数中表现出最大的下降。
表 2 内部(SEV)和外部(TCGA 和 SMC)验证队列中的多实例学习模型在预测铂类治疗反应组中的表现
3.PathoRiCH + BRCA + HRD的最佳PFI预测能力
为了在内部和外部验证中实现平衡的良好性能,我们选择了癌症分割区域20倍放大倍率MIL并将其命名为PathoRiCH。在Kaplan-Meier分析中,PathoRiCH在内部(SEV)和外部(TCGA)验证队列中确定的有利组和较差组显示出显著差异的PFI(分别为p < 0.001和p = 0.032)(图2a、b)。当PathoRiCH结果与TCGA队列中的BRCA和HRD状态(PathoRiCH+ BRCA + HRD)相结合时,患者可以进一步分为四个亚组:有利–BRCA/HRD阳性(47.8%)、有利–BRCA/HRD阴性(31.7%)、差–BRCA/HRD阳性(10.4%)和差–BRCA/HRD阴性(10.1%),与仅使用分子生物标志物相比,可以实现更精确的风险分层。有利的BRCA/HRD阳性组显示出最好的PFI,有利的BRCA/HRD阴性组显示出中等的PFI,而较差的BRCA/HRD阳性组和较差的BRCA/HRD阴性组显示出最差的PFI(p < 0.001)(图3a)。此外,PathoRiCH+ BRCA + HRD定义的亚组显示四个PFI组的分布显著不同(p = 0.001)(图3b)。
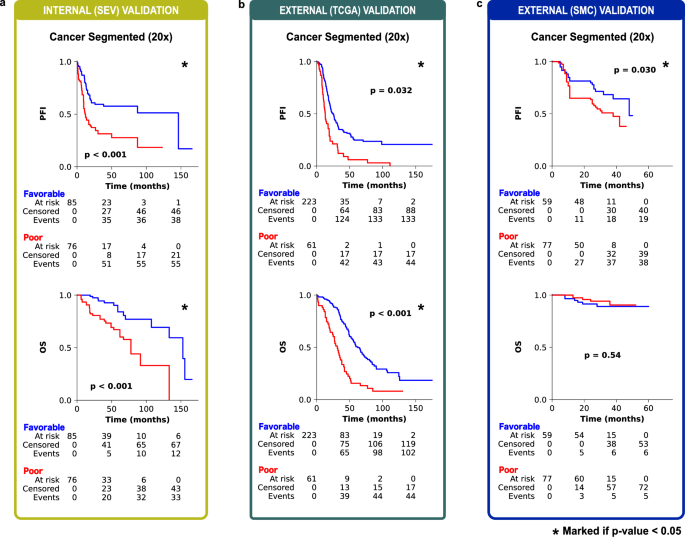
图2 Kaplan-Meier生存分析
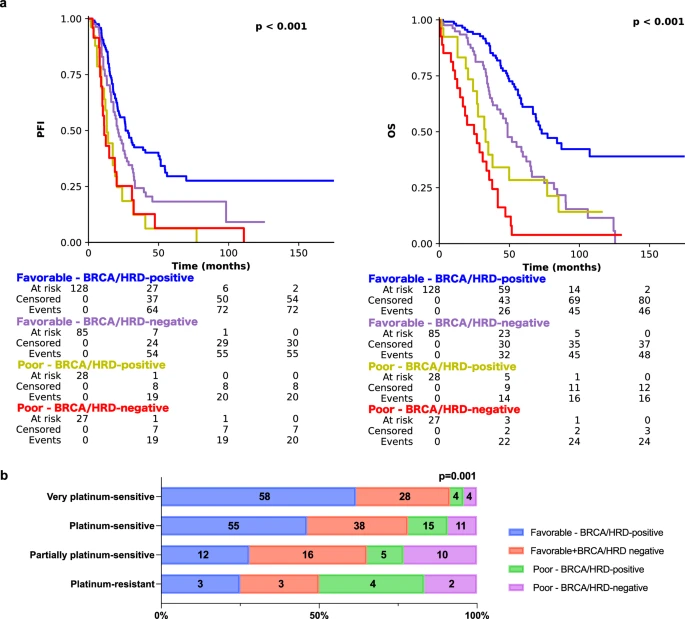
图3 结合分子标志物后的Kaplan-Meier生存分析
在额外的独立外部(SMC)验证队列中,PathoRiCH的AUC-ROC值为0.593(表2)。在SMC队列中,PathoRiCH预测的良好和不良反应组也表现出PFI的统计显著差异(p = 0.030)(图2c)。由于SMC数据集不提供HRD结果,因此PathoRiCH+ BRCA + HRD组合不可用。补充图4显示了对地面实况有利组和较差组的Kaplan-Meier分析。
在多变量Cox回归分析中,PathoRiCH被确定为最强的独立预后因素(p < 0.0001),风险比为1.947(95%置信区间=1.350–2.808,p < 0.001),FIGO分期和BRCA状态也被确定为独立的预后因素(分别为p = 0.005和p = 0.32)(图4a)。补充图5a显示了四个PFI组根据BRCA突变和HRD状态的Kaplan-Meier图和分布。
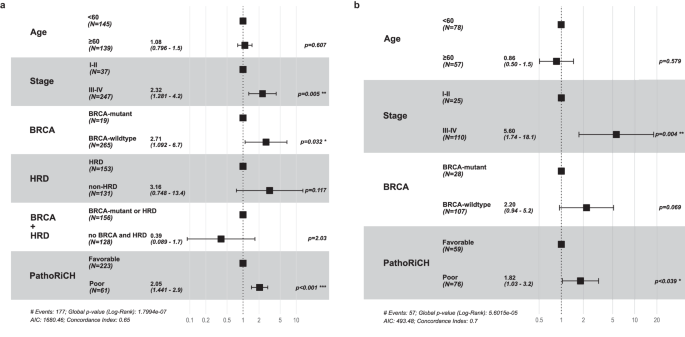
图4 多变量Cox回归分析
由于PathoRiCH根据属于有利组或较差组的预测概率做出决策,因此我们生成了三个注意力图:有利组预测、较差组预测和组合预测(图5)。基于这样的假设,即具有极端治疗反应的患者可能比具有中等反应的患者具有更多的预测性组织学特征,我们为SEV队列中反应非常良好和不良的40例患者(WSI n = 76)提取了高分斑块(斑块n = 3500,分别)。通过应用高斯混合模型(GMM)聚类算法和病理学家的评估,我们将好组和差组的高分斑块分别分类为四个组织学上不同的簇。在有利组中,发现了显示“瘤内淋巴细胞浸润”和“具有高细胞结构的小单调核”的独特簇(图6a)。相反,“粘性差和纺锤形特征的深染细胞核”和“细胞质空泡和微囊性改变”是差组中明显的组织学特征(图6b)。两组中其余的簇都显示出重叠的组织学特征。
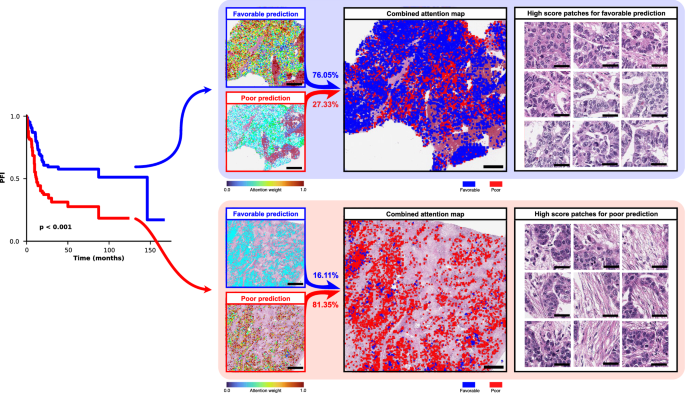
图5 注意力图
以“瘤内淋巴细胞浸润”为特征的簇被确定为有利组主导(有利斑块> 80%),而较差组中的明显组织学特征,“粘着性差和纺锤形特征的深染核”和“细胞质空泡和微囊性变化”被确定为不良组主导(不良斑块> 80%)(图6c)。
 图6 组织学特征
图6 组织学特征
PathoRiCH模型通过病理图像成功预测了HGSOC患者对铂类药物的反应,其准确性优于现有的分子标志物。结合BRCA和HRD状态后,模型的预测性能进一步提升,为个体化治疗提供了可靠依据。
Ahn, B., Moon, D., Kim, HS. et al. Histopathologic image–based deep learning classifier for predicting platinum-based treatment responses in high-grade serous ovarian cancer. Nat Commun 15, 4253 (2024). https://doi.org/10.1038/s41467-024-48667-6
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批号:CN-136497
责任编辑:肿瘤资讯-Elva
排版编辑:肿瘤资讯-Niko版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。