在过去的十几年中,T细胞免疫检查点的发现和抑制检查点的单克隆抗体的开发极大地改变了免疫治疗的结果。然而,PD-1的治疗仍然只有10-30%的患者表现出长期,持久的反应,大多数人群缺乏响应,还有获得性耐药以及免疫相关不良事件(IRAE)也是巨大的障碍。克服PD-1治疗局限性的机制之一是针对与肿瘤微环境相关的其他免疫检查点。
目前,TIGIT被认为是最有前景和潜力的靶点之一,多种证据支持TIGIT在限制肿瘤的适应性免疫和固有免疫方面起着关键作用。下面,小编就带大家来一起回顾一下TIGIT在肿瘤免疫学中的作用以及目前基于TIGIT的肿瘤免疫治疗的研究进展。
TIGIT(也称为WUCAM、Vstm3、VSIG9)是Ig超家族的一种受体,在限制适应性和固有免疫方面起着关键作用。TIGIT参与了一个复杂的调控网络,涉及多个IRs(例如,CD96/TACTILE,CD112R/PVRIG)、一个竞争性共刺激受体(DNAM-1/CD226)和多个配体(例如,CD155,CD112)。因此,与CD28/CTLA-4/CD80/CD86通路有一些相似之处,抑制性受体和共刺激受体竞争性地与同一配体结合。
TIGIT由活化的CD8+T和CD4+T细胞、自然杀伤(NK)细胞、调节性T细胞(Tregs
)和滤泡辅助性T细胞表达。与DNAM-1/CD226形成鲜明对比,TIGIT在原始T细胞弱表达。在癌症中,TIGIT与PD-1在小鼠和人类肿瘤抗原特异性CD8+T细胞和CD8+肿瘤浸润淋巴细胞(TIL)上共表达。它还与其他IRs共表达,如在肿瘤中耗竭的CD8+T细胞上的TIM-3和LAG-3。此外,TIGIT在健康人和癌症患者的外周血单核细胞中高表达,并在TME中进一步上调。
TIGIT结合两个配体,CD155和CD112,在单核细胞、树突状细胞(DC)和许多非造血细胞(包括不同组织学类型的肿瘤细胞)上表达。TIGIT结合CD155的亲和力高于竞争受体CD226和CD96。

TIGIT与CD112弱结合,CD112R结合CD112的亲和力高于CD226。有趣的是,CD155的表达在活性氧依赖的DNA损伤反应激活时增加,该反应调节NK细胞与T细胞和骨髓源性抑制细胞(MDSCs)的相互作用。此外,Fap2蛋白来自核梭杆菌(Fusobacterium nucleatum)是一种与结直肠癌相关的厌氧革兰氏共生菌,可直接与TIGIT结合,但不能与CD226结合,从而抑制NK细胞和T细胞介导的肿瘤反应。这些发现表明,肠道微生物组以TIGIT介导的方式调节固有免疫反应。
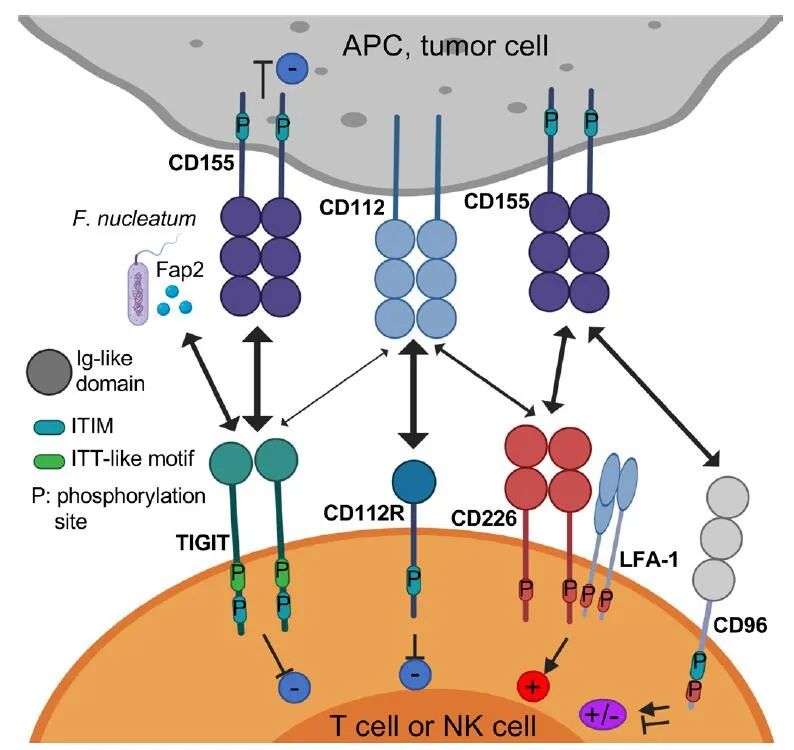
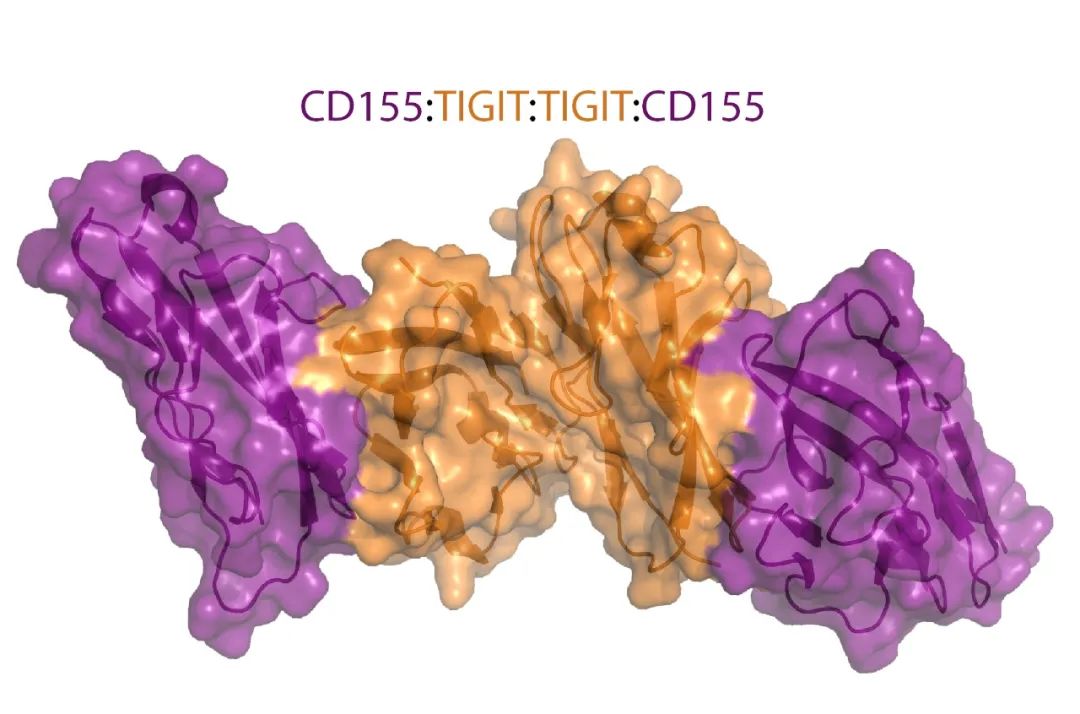
TIGIT由一个细胞外免疫球蛋白(Ig)可变结构域、1型跨膜结构域和一个胞内结构域组成,胞内结构域其具有两个在小鼠和人类中保守的抑制基序:免疫受体基于酪氨酸的抑制基序(ITIM)和Ig尾酪氨酸样(ITT)基序。结合到CD155的TIGIT晶体结构显示两个TIGIT/CD155二聚体形成一个以TIGIT/TIGIT顺式同源二聚体为核心的异四聚体,每个TIGIT分子与一个CD155分子结合。这种顺反式受体聚集介导细胞粘附和信号传递。
在小鼠中,ITIM(Y227)或ITT样基序残基(Y233)的磷酸化可触发TIGIT抑制信号。然而,在人NK细胞系YTS中,TIGIT/CD155结合通过一个ITT样基序启动主要的抑制信号,而ITIM基序介导一个较小的抑制信号。在TIGIT/CD155结合激活后,ITT样基序在Tyr225处磷酸化,并与胞浆内信号分子Grb2和β-arrestin 2结合以招募含有肌醇的SH2磷酸酶-1(
SHIP-1)。SHIP-1阻碍磷酸肌醇3激酶和丝裂原活化蛋白激酶信号传导。SHIP-1还抑制TRAF6和NF-κB的激活,导致NK细胞产生IFN-γ减少。
TIGIT通过多种机制潜在地抑制固有和适应性免疫。首先,在小鼠模型中,TIGIT通过与DCs上的CD155结合间接地阻碍T细胞的功能。TIGIT与DCs的结合诱导CD155磷酸化并触发一个信号级联反应,促进形成免疫耐受性DCs,降低IL-12的产生并导致IL-10的增加。
第二,TIGIT直接表现出免疫细胞的内在抑制作用。在小鼠和人类中,TIGIT抑制NK细胞脱颗粒、细胞因子生成和NK细胞介导的CD155+肿瘤细胞的细胞毒性。TIGIT+NK细胞与表达CD155的MDSCs相互作用降低了ZAP70/Syk和ERK1/2的磷酸化,降低了NK细胞的细胞溶解能力。
第三,多项证据表明TIGIT阻碍CD155介导的CD226活化。CD226是一种共刺激受体,广泛表达于免疫细胞,包括T细胞、NK细胞、单核细胞等,以及血小板。TIGIT以比CD226更高的亲和力结合CD155,从而限制CD226介导的激活。另外,TIGIT还直接在细胞上顺式结合CD226,破坏其与CD155的同源二聚体的结合能力。
第四,TIGIT/CD226表达的平衡调节T细胞和NK细胞的效应功能。在TCR激活的CD4+T细胞中,用shRNA敲除TIGIT的表达增加了T-bet的表达和IFN-γ的产生;相反,CD226基因敲除可降低T-bet表达和IFN-γ的产生。可以通过平衡CD8+T细胞中的CD226和TIGIT来增强T细胞介导的肿瘤排斥反应。
第五,TIGIT作用于Tregs,增强免疫抑制功能和稳定性。与TIGIT−Tregs相比,TIGIT+Tregs在外周和肿瘤部位上调了许多Treg基因标志物,包括Foxp3、Helios、neuronilin-1、CTLA-4、PD-1和LAG-3。TIGIT+Tregs还抑制Th1和Th17的促炎性反应,但不抑制Th2。TIGIT激活后,TIGIT++Tregs产生IL-10和纤维蛋白原样蛋白2,介导T细胞抑制。 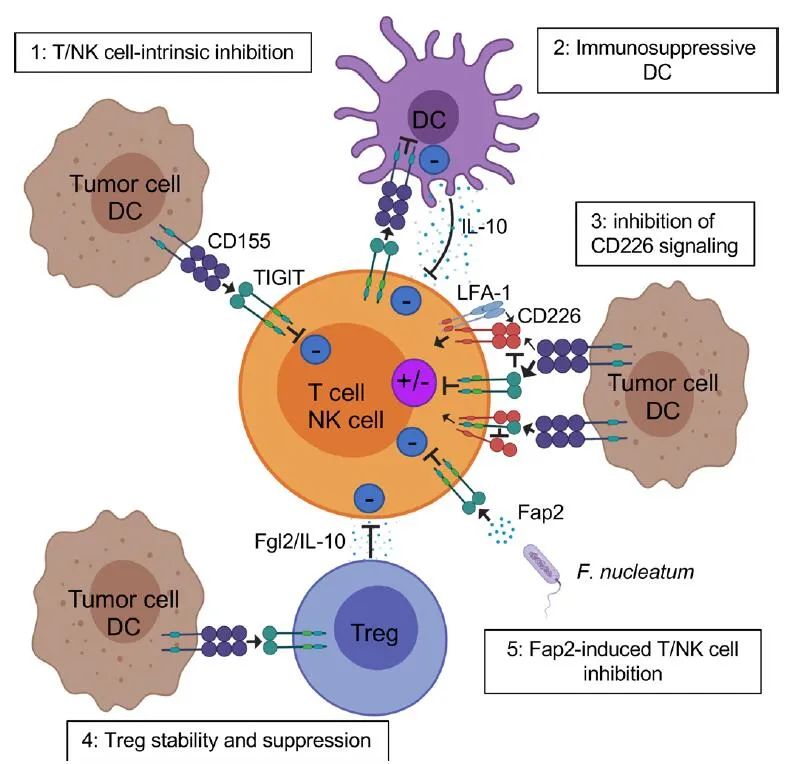
目前,靶向TIGIT-PVR途径变得越来越重要,一些生物技术/制药公司正在致力于开发抗TIGIT的抗体或双抗。截至2021年底,共有23种针对TIGIT的单抗或双抗正在商业化开发,并处于不同的临床开发阶段。
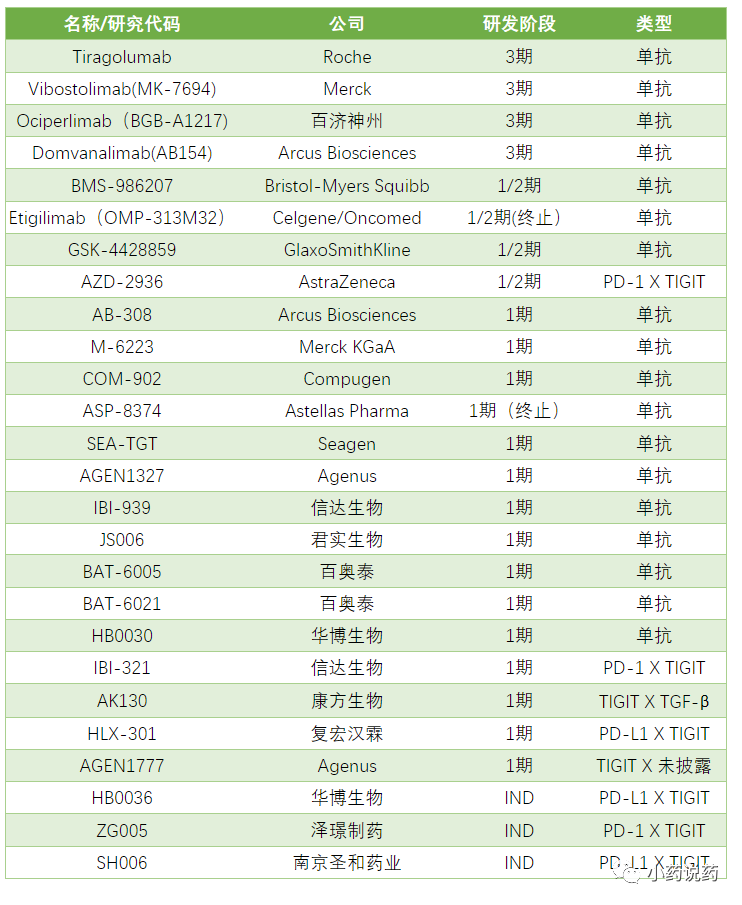
放眼全球,开发者不乏罗氏、百时美施贵宝、默沙东等头部大药企的身影。其中,进度最快的当属罗氏、默沙东,均处于临床Ⅲ期。
国内药企在TIGIT进度也并不落后,百济神州、信达生物、君实生物、百奥泰、复宏汉霖、康方生物等纷纷入局。其中,百济神州的研发进度最快,已经进入到临床Ⅲ期,与罗氏、默沙东的进度持平。
2021年12月20日,百济神州与诺华达成合作协议,诺华将获得百济神州TIGIT抗体的美国、加拿大、欧洲多国及日本的权益。为此,诺华将支付3亿美元预付款,6亿美元或7亿美元的额外付款,18.95亿美元里程碑金额以及20-25%的销售分成。
实际上,2021年以来,海外大药企围绕TIGIT的重磅交易层出不穷。5月19日,百时美施贵宝宣布以2亿首付、13.6亿潜在里程金收购Agenus还在临床前的TIGIT双抗AGEN1777;6月14日,葛兰素史克与iTeosTherapeutics达成合作协议,引进后者研发的TIGIT单抗EOS-448,葛兰素史克支付6.25亿美元预付款+14.5亿美元里程碑金额。显然,TIGIT单抗的军备竞赛已经逐渐白热化。
一些因素,如抗体骨架的来源(小鼠、嵌合、人源化或全人类)、抗体的IgG骨架、FcγR结合状态和剂量,在抗体的开发和最终临床成功中起着关键作用。
来源
用于治疗应用的抗体的来源可以显著影响分子的临床成功。到目前为止,所有经批准的免疫检查点阻断剂要么是人源化的,要么是全人源的,临床开发中的大多数抗TIGIT抗体都是完全人源抗体。
FcγR结合状态
几乎所有商业开发的免疫检查点阻断抗体都有IgG骨架。已知基于IgG的抗体通过其Fc区域与先天效应免疫细胞上的FcγR相互作用,并在靶细胞中诱导抗体依赖性细胞毒性(ADCC)。ADCC是治疗性抗体研制过程中考虑的最常见因素,但其对免疫检查点阻断剂活性的作用尚不完全清楚。
在临床发展中,抗TIGIT抗体的FcγR结合区在某些分子中是活跃的,而在其他分子中是失活的。根据公开信息, tiragolumab、ociperlimab、vibostolimab、EOS-448、etigilimab和AGEN-1307具有活性FcγR结合区,而domvanalimab和BMS-986207,具有非活性FcγR结合区。抗体中FcγR结合区的存在或缺失是否会对抗TIGIT抗体的临床疗效产生影响仍有待观察。
剂量
各种因素,包括亲和力,药效学因素和药代动力学因素都影响到最大耐受剂量和药物预期产生最大效果的剂量。多个临床项目的I期研究结果表明,抗TIGIT抗体具有良好的耐受性。
研究使用不同剂量范围的抗体,每两周(Q2W)或每三周(Q3W)给药一次。在临床开发过程中,任何抗TIGIT抗体的单药治疗或与抗PD-1抗体联合治疗均未记录剂量限制性毒性,表明针对该靶点的分子具有广泛的治疗指数。抗TIGIT抗体单药治疗后观察到的临床活性很低,甚至为零,表明需要与抗PD-1/PD-L1或其他药物联合治疗。
安全性
当作为单一疗法以及与PD-1/PD-L1阻滞剂联合使用时,发现抗TIGIT抗体通常具有良好的耐受性。超过10%的患者报告的最常见不良事件包括疲劳和瘙痒,都是1级。在接受vibostolimab单药治疗的两名患者中报告了两个2级事件,即贫血和腹泻。抗TIGIT抗体单一疗法未报告3级或以上不良事件。
TIGIT是肿瘤免疫治疗的一个很有前途的靶点,特别是与PD-1阻断剂联合应用。然而,随着基于TIGIT的癌症患者临床试验的进展,我们需要解决许多关键问题和挑战。首先,TIGIT阻断剂对癌症患者的作用机制是什么?这些效应主要是由其在CD8+T细胞、Tregs或两者中的直接活性介导的吗?TIGIT能阻断TME中APCs的重编程以增加T细胞的启动或激活吗?这些影响是否会因疾病阶段的不同而有所不同?TIGIT阻断剂能否在体内介导NK细胞介导的对MHCⅠ类缺陷肿瘤的反应性,这是否为PD-1难治性癌症患者提供临床益处的机会?而且,除了PD-1/TIGIT双重阻断剂外,CD112R或CD96阻断剂是否有任何潜在的协同效应,如小鼠肿瘤模型和体外研究所示?在这方面,我们必须记住,CD96作为IR的作用仍然存在争议。此外,CD112R阻断可以潜在地增强自体人类肿瘤抗原特异性CD8+T细胞的证据仍然缺失。
另外,CD226在PD-1/TIGIT双重阻断中起着重要的调节作用。TME中CD8+T细胞和NK细胞的下调可能是PD-1/TIGIT双重阻断成功的主要障碍。因此,有必要设计新的策略来增加CD226的表达和信号传递,以防止其在TME中的下调。值得注意的是,一项正在进行的临床试验是在多种癌症中测试抗CD226的激动剂(NCT04099277)。然而,由于CD226在介导血小板粘附和活化中的作用,潜在的血液学不良事件需要仔细监测。最后,使用不同工程化Fc抗TIGIT单抗的临床试验可能有助于确定FcγR协同在TIGIT阻断中的作用。
总之,TIGIT在发现后仅10年,就已经作为免疫治疗的靶点进入临床试验。随着对TIGIT介导的免疫反应调节研究的深入,将有助于针对癌症患者进行TIGIT阻断剂的优化组合策略设计,也将有助于开发靶向TIGIT疗法来治疗其他表达该蛋白的慢性疾病。
参考文献:
1. TIGIT in cancer immunotherapy. J Immunother Cancer 2020;8:e000957.
2. Targeting TIGIT for Immunotherapy of Cancer: Update on Clinical Development. Biomedicines. 2021 Sep; 9(9):1277.
3. 各公司官网
