 Good Therapeutics日前宣布,已经与罗氏(Roche)确认达成交易协议。
Good Therapeutics日前宣布,已经与罗氏(Roche)确认达成交易协议。
根据双方的协议约定,罗氏将获得Good Therapeutics公司的创新、条件性活化、由PD-1调节的IL-2项目,以及通过公司平台技术开发PD-1调节的IL-2受体激动剂疗法的专属权利。
媒体信息显示,双方交易达成之后,罗氏将会支付Good Therapeutics公司2.5亿美元的预付款,并根据预定的开发、监管与商业里程碑支付对应款项;Good Therapeutics还将更名为Bonum Therapeutics,并以新公司名称继续使用蛋白别构技术平台开发其它免疫肿瘤药物。
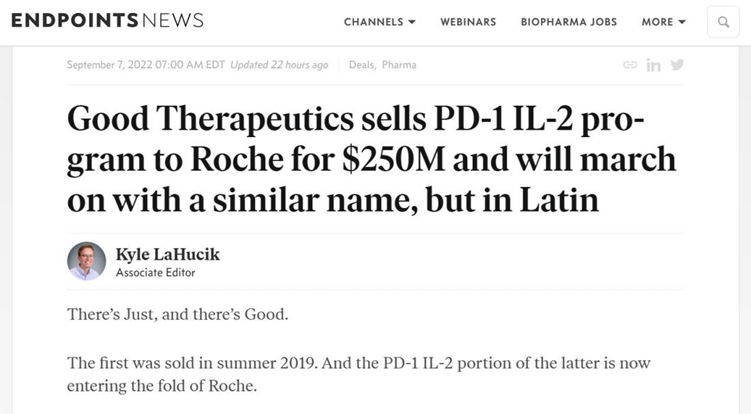
据悉,Good Therapeutics公司聚焦于使用蛋白别构科技开发邻近依赖性(context-dependent)细胞因子调节药物以加强体内抗肿瘤反应。其主要项目包含PD-1-IL2蛋白,其可靶向PD-1以专一地借着IL-2活化肿瘤内T细胞以提升抗肿瘤反应。除此之外,该公司还有以干扰素(IFN)-α为基础,作用于免疫抑制肿瘤微环境的相关项目。
截至目前,Good Therapeutics共有六个项目涵盖IL-12、干扰素α,TGF-β等。而其中涉及PD-1领域的项目就有两个,PD-1-IL2的项目更是Good Therapeutics旗下进展最快的主研项目,处于即将进入临床前研究的阶段。
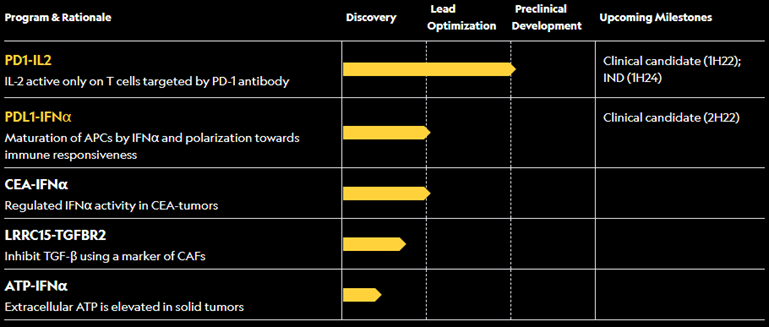
值得关注的是,作为一种在维持T淋巴细胞和天然杀伤(NK)细胞的正常功能中起着重要作用的球状糖蛋白,IL-2靶点可以算得上是癌症免疫治疗界的“老兵”。早在1984年,一名33岁患转移性黑色素瘤女性患者接受了IL-2治疗,帮助效应T细胞的扩增,取得了良好的治疗效果。
然而,IL-2相关产品在研发的过程中,也被发现存在一定的风险,即IL-2疗法需要很高的剂量才能产生效果,而且毒性强。近年来,研究人员不断通过创新技术改进IL-2药物以最大化疗效,进一步提高选择性,降低系统毒性。
事实上,包括罗氏、Nektar/BMS、Synthorx/赛诺菲、默沙东等企业,均在IL-2的研发赛道上加速奔跑。其中,罗氏已于2020年将其IL-2v–anti-PD1融合候选分子RG6279推进到I期临床试验,观察其作为一种单药,以及与PD-L1抗体Tecentriq(阿替利珠单抗)联合的治疗潜力。
不过,IL-2领域的研发热潮在今年急转直下。
今年4月份,Nektar/BMS共同宣布,将终止Nektar的聚乙二醇化IL-2细胞因子与BMS的抗PD-1免疫疗法Opdivo的联用,引发了学术界和产业界对于这一靶点研发前景的担忧。
一直以来,PD-1作为“百年一遇”的划时代突破,推开了肿瘤免疫时代的大门,寻找“后PD-1时代”的创新技术和革命性药物,已经成为众多Biotech和MNC的重要目标。
截至目前,新的曙光仍然未能出现。就在前不久,在被寄予厚望的TIGIT靶点上,罗氏作为进展最快的玩家,重重地栽了跟头。
今年3月,“Tiragolumab+Tecentriq”组合一线用于广泛期小细胞肺癌的Ⅲ期临床(SKYSCRAPER-02)未达PFS终点;短短两个月后,罗氏宣布了SKYSCRAPER-01研究的中期数据,Tiragolumab联合PD-L1单抗Tecentriq vs. Tecentriq单药一线治疗PD-L1高表达局部晚期或转移性非小细胞肺癌(NSCLC)患者,研究结果未达到无进展生存期(PFS)的共同主要终点。
错失小细胞肺癌和非小细胞肺癌两个临床试验,不仅让TIGIT靶点的研发前景蒙上了阴影,也让海外资本市场投资者纷纷用脚投票,多家公司受“TIGIT概念”影响直接崩盘。
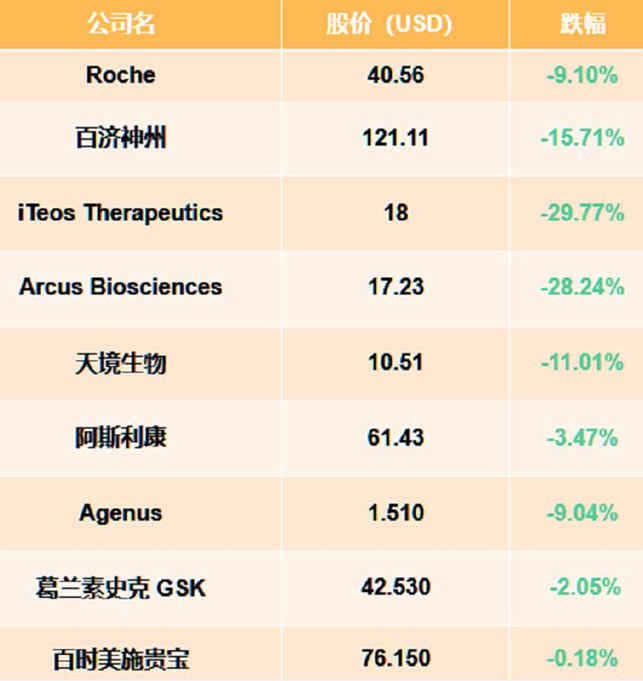
(5月份受TIGIT概念影响的相关企业股价)
前沿创新与风险永远如影随形。后PD-1时代,聚焦未被满足的临床需求,肿瘤免疫治疗始终寄希望于新靶点、新联合疗法,TIGIT、CD47、LAG3、OX40等靶点前仆后继,致力于改进免疫治疗格局,谁能熬得过九死一生这道门槛,才能够成为新时期的领军者,IL-2会是下一个希望吗?
