免疫抑制性受体(IRs)在调节慢性病毒感染和癌症的固有和适应性免疫中发挥着重要的作用。在慢性抗原刺激下,T细胞功能失调或衰竭并上调许多IRs,包括程序性细胞死亡受体1(PD-1)和带有免疫球蛋白和ITIM结构域的T细胞免疫受体(TIGIT)。同时,肿瘤细胞和抗原呈递细胞(APCs)在肿瘤微环境(TME)中表达IR配体,这导致肿瘤细胞可以逃避免疫监视。用单克隆抗体(MAB)靶向IRs已经证明了在小鼠肿瘤模型和人类中的抗肿瘤作用,目前用抗细胞毒性T淋巴细胞相关抗原4(CTLA-4)、抗PD-1或两者联用成为许多实体瘤的标准治疗方法。多种证据支持TIGIT在限制肿瘤的适应性免疫和固有免疫方面起着关键作用。下面,我们来一起回顾TIGIT在肿瘤免疫学中的作用以及基于TIGIT的肿瘤免疫治疗临床结果。
TIGIT(也称为WUCAM、Vstm3、VSIG9)是Ig超家族的一种受体,在限制适应性和固有免疫方面起着关键作用。TIGIT参与了一个复杂的调控网络,涉及多个IRs(例如,CD96/TACTILE,CD112R/PVRIG)、一个竞争性共刺激受体(DNAM-1/CD226)和多个配体(
例如,CD155(PVR/NECL-5),CD112(Nectin-2/PVRL2))。因此,与CD28/CTLA-4/CD80/CD86通路有一些相似之处,抑制性受体和共刺激受体竞争性地与同一配体结合。与CTLA-4-/-小鼠形成鲜明对比的是,TIGIT-/-小鼠不会产生自身免疫。然而,与野生型小鼠相比,当用髓鞘少突胶质细胞糖蛋白进行免疫时,TIGIT-/-小鼠会发生更严重的实验性自身免疫性脑炎。这样的观察结果支持了TIGIT作为T细胞负性调节器的作用功能。
TIGIT由活化的CD8+T和CD4+T细胞、自然杀伤(NK)细胞、调节性T细胞(Tregs)和滤泡辅助性T细胞表达。与DNAM-1/CD226形成鲜明对比,TIGIT在原始T细胞弱表达。在癌症中,TIGIT与PD-1在小鼠和人类肿瘤抗原特异性CD8+T细胞和CD8+肿瘤浸润淋巴细胞(TIL)上共表达。它还与其他IRs共表达,如在肿瘤中耗竭的CD8+T细胞上的TIM-3和LAG-3。此外,TIGIT在健康人和癌症患者的外周血单核细胞中高表达,并在TME中进一步上调。
TIGIT表达增加与Tregs中TIGIT位点的低甲基化和FOXP3结合有关,从而将Tregs与活化的效应因子CD4+T细胞区分开来。与小鼠脾NK细胞相比,人类循环中的NK细胞表现出高TIGIT表达,调节着它们的肿瘤杀伤活性。与CD8+T细胞形成鲜明对比的是,转移性肿瘤中低频率出现的NK细胞是功能失调的,并下调TIGIT和CD226的表达。膜结合的CD155触发CD226的内化和降解,导致NK细胞介导的肿瘤反应性降低。TIGIT结合两个配体,CD155和CD112,在单核细胞、树突状细胞(DC)和许多非造血细胞(包括不同组织学类型的肿瘤细胞)上表达。TIGIT结合CD155的亲和力高于竞争受体CD226和CD96。

TIGIT与CD112弱结合,CD112R结合CD112的亲和力高于CD226。有趣的是,CD155的表达在活性氧依赖的DNA损伤反应激活时增加,该反应调节NK细胞与T细胞和骨髓源性抑制细胞(MDSCs)的相互作用。此外,Fap2蛋白来自核梭杆菌(Fusobacterium nucleatum)是一种与结直肠癌相关的厌氧革兰氏共生菌,可直接与TIGIT结合,但不能与CD226结合,从而抑制NK细胞和T细胞介导的肿瘤反应。这些发现表明,肠道微生物组以TIGIT介导的方式调节固有免疫反应。
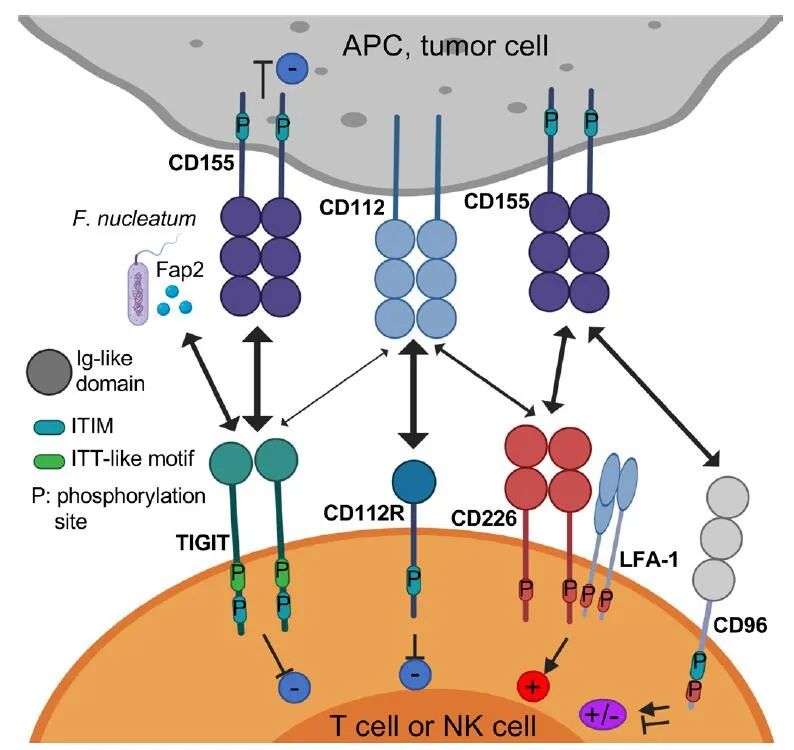
TIGIT由一个细胞外免疫球蛋白(Ig)可变结构域、1型跨膜结构域和一个胞内结构域组成,胞内结构域其具有两个在小鼠和人类中保守的抑制基序:免疫受体基于酪氨酸的抑制基序(ITIM)和Ig尾酪氨酸样(ITT
)基序。结合到CD155的TIGIT晶体结构显示两个TIGIT/CD155二聚体形成一个以TIGIT/TIGIT顺式同源二聚体为核心的异四聚体,每个TIGIT分子与一个CD155分子结合。这种顺反式受体聚集介导细胞粘附和信号传递。
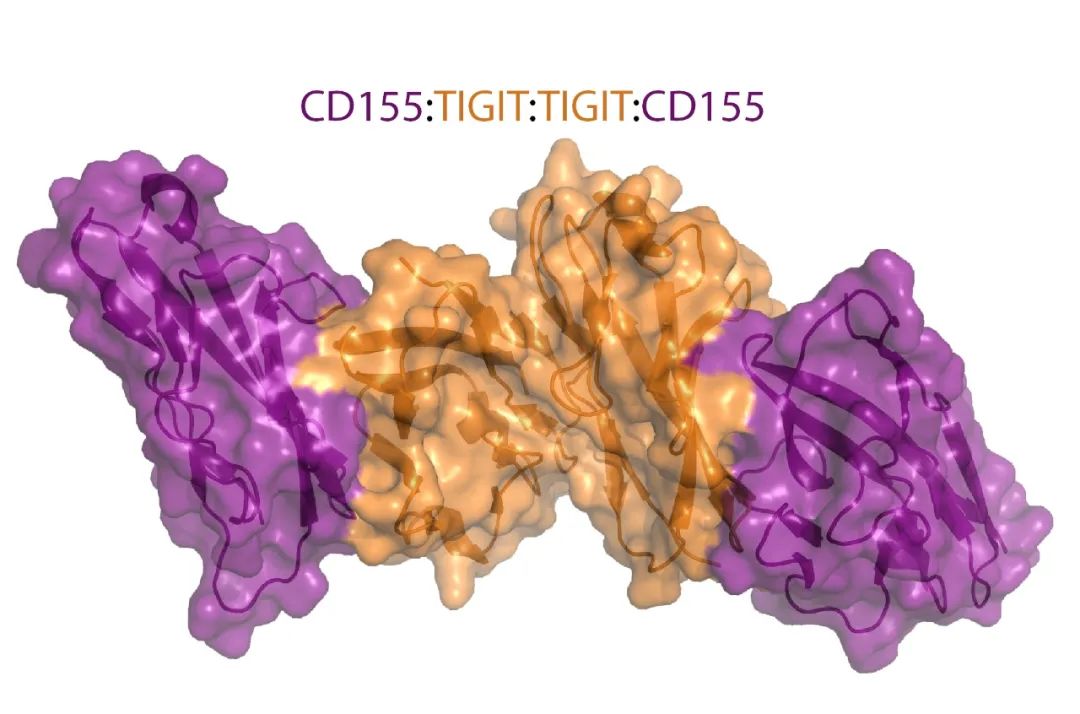
在小鼠中,ITIM(Y227)或ITT样基序残基(Y233)的磷酸化可触发TIGIT抑制信号。然而,在人NK细胞系YTS中,TIGIT/CD155结合通过一个ITT样基序启动主要的抑制信号,而ITIM基序介导一个较小的抑制信号。在TIGIT/CD155结合激活后,ITT样基序在Tyr225处磷酸化,并与胞浆内信号分子Grb2和β-arrestin 2结合以招募含有肌醇的SH2磷酸酶-1(SHIP-1)。SHIP-1阻碍磷酸肌醇3激酶和丝裂原活化蛋白激酶信号传导。SHIP-1还抑制TRAF6和NF-κB的激活,导致NK细胞产生IFN-γ减少。
TIGIT通过多种机制潜在地抑制固有和适应性免疫。首先,在小鼠模型中,TIGIT通过与DCs上的CD155结合间接地阻碍T细胞的功能。TIGIT与DCs的结合诱导CD155磷酸化并触发一个信号级联反应,促进形成免疫耐受性DCs,降低白细胞介素(IL)-12的产生和IL-10的增加。
第二,TIGIT直接表现出免疫细胞的内在抑制作用。抗TIGIT的激动剂抗体通过减弱T细胞受体(TCR)驱动的激活信号来抑制T细胞增殖和功能。在小鼠和人类中,TIGIT抑制NK细胞脱颗粒、细胞因子生成和NK细胞介导的CD155+肿瘤细胞的细胞毒性。TIGIT+NK细胞与表达CD155的MDSCs相互作用降低了ZAP70/Syk和ERK1/2的磷酸化,降低了NK细胞的细胞溶解能力。
第三,多项证据表明TIGIT阻碍CD155介导的CD226活化。CD226是一种共刺激受体,广泛表达于免疫细胞,包括T细胞、NK细胞、单核细胞等,以及血小板。CD226与LFA-1结合以促进细胞接触并触发TCR信号。该受体还促进CD4+T细胞与CD155结合产生促炎性细胞因子。CD226直接参与小鼠和人类的T细胞和NK细胞识别肿瘤,CD226缺陷小鼠的CD8+T细胞和NK细胞显示免疫突触缺陷,导致抗肿瘤免疫作用的缺失。TIGIT以比CD226更高的亲和力结合CD155,从而限制CD226介导的激活。另外,TIGIT还直接在细胞上顺式结合CD226,破坏其与CD155的同源二聚体的结合能力。
第四,TIGIT/CD226表达的平衡调节T细胞和NK细胞的效应功能。在TCR激活的CD4+T细胞中,用shRNA消除TIGIT的表达增加了T-bet的表达和IFN-γ的产生;相反,CD226基因敲除可降低T-bet表达和IFN-γ的产生。此外,CD226阻断可消除双重PD-1和TIGIT阻断对黑色素瘤中肿瘤抗原特异性CD8+T细胞增殖和细胞因子产生的影响。同样,在CT26荷瘤小鼠中,双重PD-L1/TIGIT阻断剂的抗肿瘤作用以CD226依赖的方式发生,并在CD226阻断后被清除。有趣的是,抗PD-1阻断剂和抗GITR单抗激动剂可提高MC38荷瘤小鼠的总体存活率。在这个模型中,抑制PD-1通过抑制SHP2介导的CD226去磷酸化来拯救功能障碍的CD8+T细胞,而抗GITR单克隆抗体则降低了TIGIT的表达。这些重要的发现支持了在阻断PD-1和TIGIT之外,其他免疫检查点阻断剂(ICBs)可以通过平衡CD8+T细胞中的CD226和TIGIT来增强T细胞介导的肿瘤排斥反应。
第五,TIGIT作用于Tregs,增强免疫抑制功能和稳定性。TIGIT在小鼠的自然Tregs的一个亚群中和大多数人类Tregs中高表达,而在Tregs中TIGIT上调与TIGIT位点的低甲基化和Foxp3结合有关。与TIGIT−Tregs相比,TIGIT+Tregs在外周和肿瘤部位上调了许多Treg基因标志物,包括Foxp3、Helios、neuronilin-1、CTLA-4、PD-1和LAG-3。TIGIT+Tregs还抑制Th1和Th17的促炎性反应,但不抑制Th2。TIGIT激活后,TIGIT++Tregs产生IL-10和纤维蛋白原样蛋白2,介导T细胞抑制。
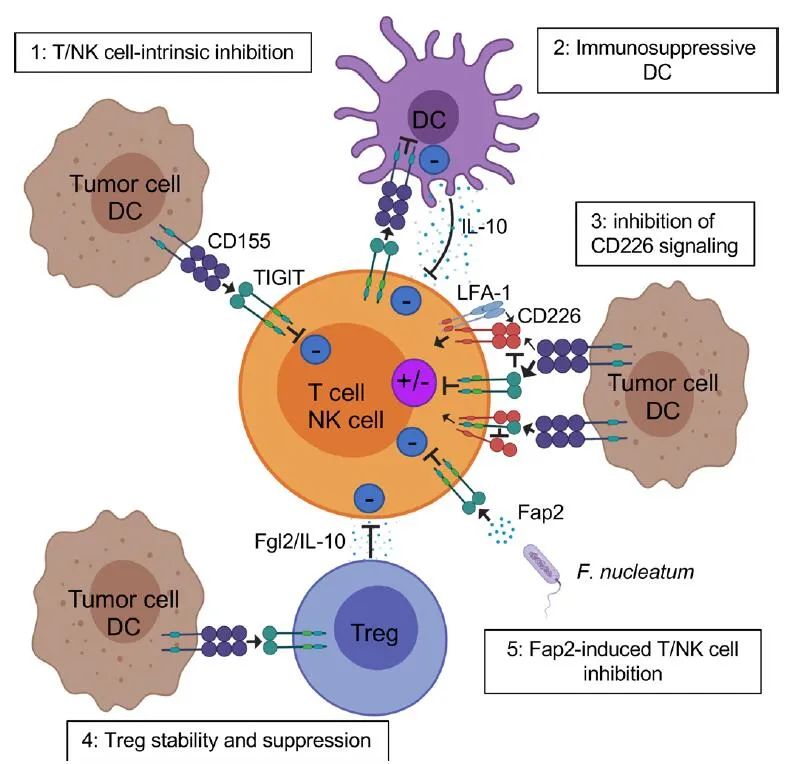
有趣的是,人Foxp3+Tregs比Foxp3−CD4+T细胞表现出更低的CD226表达。与周边相比,转移性黑色素瘤中的CD226也受到Tregs的下调,从而导致TIGIT/CD226比率增加。TIGIT和CD226相互对立,分别增强或破坏Treg的抑制和稳定性。TIGIT/CD226在Tregs中的比率似乎与肿瘤中Treg频率的增加和ICB的不良临床结果相关。还需要进一步的研究来确定Tregs中TIGIT/CD226比值是否可以作为实体瘤患者对ICB临床反应的生物标志物。
PD-1和TIGIT双重阻断剂是一种很有前途的肿瘤联合免疫治疗方法。虽然每一种阻断剂都不会显著阻碍小鼠CT26肿瘤的生长,但TIGIT和PD-1/PD-L1双重阻断剂协同作用,增强了抗肿瘤CD8+T细胞的增殖和功能,从而产生保护性记忆T细胞以及肿瘤的完全排斥反应,延长了总生存期。
与单一阻断剂相比,双PD-1/TIGIT阻断剂还增强了肿瘤抗原特异性CD8+T细胞和从黑色素瘤患者分离的TIL的增殖和功能。有趣的是,PD-L1/TIGIT双阻断剂(atezolizumab/tiragolumab)作为PD-L1阳性非小细胞肺癌患者的一线治疗,与单独使用PD-L1阻断剂相比,似乎具有更高的临床效益,尽管毒性相似。然而,这些观察结果需要在大型随机临床试验中得到证实。
PD-1/TIGIT双重阻断剂在体外和小鼠肿瘤模型的作用可以通过对CD226阻断来拮抗,表明TIGIT阻断主要通过将CD155介导的信号传导至CD226活化来发挥作用。此外,PD-1诱导SHP2介导的CD226去磷酸化,支持了双PD-1/TIGIT阻断剂促进CD226信号传导。按照这个逻辑,CD8+TILs在多个实体瘤(包括黑色素瘤)中CD226的表达下调,这可能是限制双重PD-1/TIGIT阻断剂对癌症患者影响的一个重要障碍。膜结合CD155通过CD226的内化和降解介导TME中的免疫细胞下调CD226,支持了CD155介导免疫功能障碍的作用。
在动物模型中,TIGIT阻断或TIGIT缺失在体外和体内均能促进NK细胞介导的抗肿瘤反应显著提高。最近一项对B16黑色素瘤和CT26肺转移小鼠模型的研究表明,TIGIT阻断剂单独或联合PD-1阻断剂主要作用于NK细胞,以增强CD8+T细胞介导的抗肿瘤反应方式来阻止肿瘤生长。在这些实验模型中,NK细胞特异性TIGIT缺乏和NK细胞耗竭降低了TIGIT阻断的效果。然而,许多其它研究支持单独TIGIT阻断不能显著增强CD8+T细胞免疫,并促进实体瘤移植野生型小鼠的肿瘤排斥反应。两种观察结果互相矛盾,这表明NK细胞对CD8+TIL的潜在辅助作用的机制以及这些发现与癌症患者的相关性仍然不清楚。NK细胞是否以及如何参与环境线索引导CD8+T细胞启动、成熟和记忆分化,还需要进一步研究。有趣的是,IL-15和TIGIT阻滞剂在体外可增加NK细胞介导的黑色素瘤细胞毒性,并减少小鼠黑色素瘤的转移。这个发现支持新的联合免疫疗法的开发,用IL-15和TIGIT阻断剂促进NK细胞介导的MHC I类缺陷性黑色素瘤的杀伤,这一点对CD8+T细胞介导的免疫反应不敏感。
除PD-1阻断剂外,其它ICBs联合TIGIT阻断剂也能增强抗肿瘤免疫应答。例如,TIGIT和TIM-3协同抑制小鼠的抗肿瘤免疫反应。在另一项试验中,将混合的T细胞亚群包括CD8+T细胞、CD4+T细胞和Treg细胞皮下过继转移到野生型、TIGIT-/-小鼠和携带B16F10的Rag-/-小鼠,试验结果表明TIGIT主要在Tregs中作用,阻碍CD8+T细胞的抗肿瘤反应,从而促进肿瘤生长。TIGIT+Treg浸润性肿瘤上调TIM-3,而在TIGIT-/-小鼠中阻断TIM-3,可以进一步减缓肿瘤生长,提高整体生存率。
由于TIGIT与IRs CD96和CD112R竞争结合其配体,多项研究已经调查了TIGIT和TIGIT家族中的其他IRs与PD-1的组合疗法,包括CD96和CD112R。TIGIT与CD96具有协同作用,以抑制具有肺转移的荷瘤小鼠模型的抗肿瘤反应,CD96阻断剂的抗肿瘤作用在TIGIT-/-小鼠中更高。CD96阻断剂与抗CTLA-4或抗PD-1联合使用更有效,其效果取决于NKs、CD226信号和IFN-γ的产生。此外,TIGIT阻断剂单独或与PD-1阻滞剂联合使用再加上CD96阻断剂,显著降低野生型和Cd155-/-小鼠模型中B16黑色素瘤的生长。值得注意的是,CD96作为IR的作用仍然存在争议,因为也有证据表明它可以作为CD8+T细胞的共刺激受体。在体外和小鼠模型的多个实验研究表明,CD112R阻断联合TIGIT阻断可提高抗肿瘤免疫反应。CD112R阻断剂与TIGIT阻滞剂协同作用,增强了体外抗乳腺癌细胞由NK细胞触发的抗体依赖性细胞毒性(ADCC)。在MC38肿瘤小鼠模型中,相对于单一阻断,双重CD112R/PD-L1阻断具有明显改善。此外,CD112R阻断剂单独或与TIGIT阻断剂和/或PD-1阻断剂联合使用,都能增加卵巢、子宫内膜和肺肿瘤TIL产生细胞因子的能力。
多项研究表明,抗CTLA-4单抗通过ADCC介导的Treg耗竭发挥作用。由于Tregs在TME中高表达TIGIT,人们怀疑具有Fc受体结合能力的抗TIGIT单抗是否会导致Treg的耗竭。有趣的是,在小鼠肿瘤模型中,带有抗TIGIT单抗Fc突变体显示与APCs的FcγR选择性结合增强了抗原特异性T细胞反应和肿瘤反应性,而没有Treg耗竭的证据。是否抗TIGIT抗体对癌症患者的抗肿瘤作用是Fc依赖的,有待进一步研究。这个关键问题的答案可以通过多个I期和II期临床试验来提供,这些临床试验是测试工程化FC的抗TIGIT的单抗:IgG1(MTIG7192/Genentech、MK-7684/Merck和OP-313M32/Oncomed)、惰性Fc-IgG1(BMS-986207/Bristol-Myers-Squibb;AB-154/Arcus)和IgG4(ASP8374/Potenza/Astellas)。
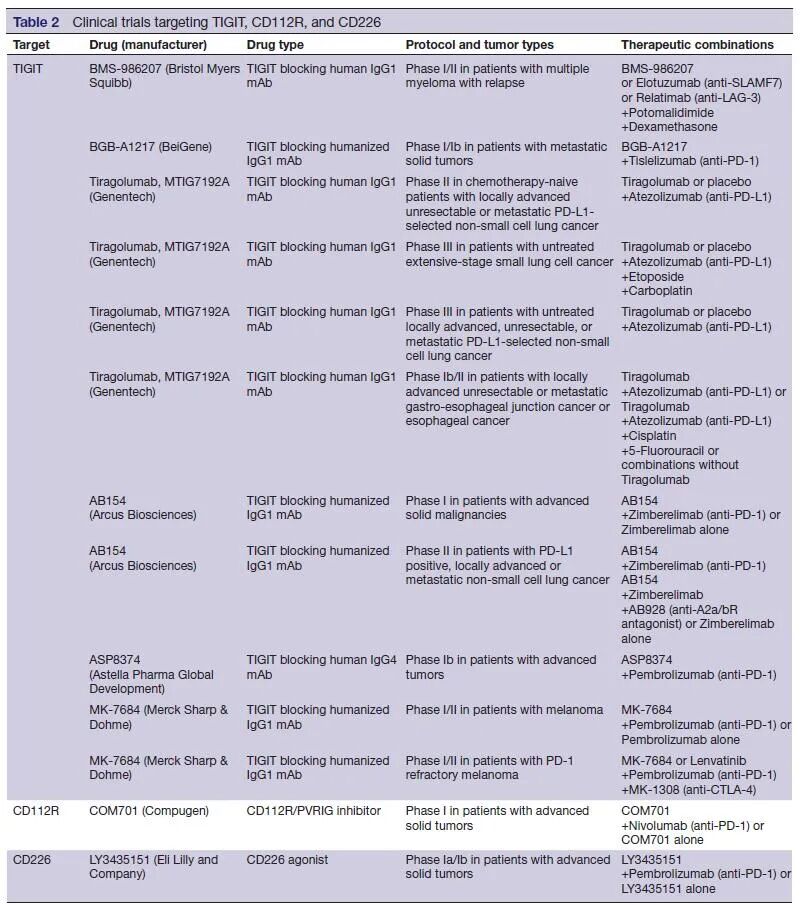
TIGIT是肿瘤免疫治疗的一个很有前途的靶点,特别是与PD-1阻断剂联合应用。然而,随着基于TIGIT的癌症患者临床试验的进展,我们需要解决许多关键问题和挑战。首先,TIGIT阻断剂对癌症患者的作用机制是什么?这些效应主要是由其在CD8+T细胞、Tregs或两者中的直接活性介导的吗?TIGIT能阻断TME中APCs的重编程以增加T细胞的启动或激活吗?这些影响是否会因疾病阶段的不同而有所不同?TIGIT阻断剂能否在体内介导NK细胞介导的对MHCⅠ类缺陷肿瘤的反应性,这是否为PD-1难治性癌症患者提供临床益处的机会?而且,除了PD-1/TIGIT双重阻断剂外,CD112R或CD96阻断剂是否有任何潜在的协同效应,如小鼠肿瘤模型和体外研究所示?在这方面,我们必须记住,CD96作为IR的作用仍然存在争议。此外,CD112R阻断可以潜在地增强自体人类肿瘤抗原特异性CD8+T细胞的证据仍然缺失。这个重要问题的答案可能来自第一阶段临床试验,评估一种CD112R抑制剂单独或联合抗PD-1单克隆抗体对晚期实体瘤患者的疗效(NCT03667716)。
另外,CD226在PD-1/TIGIT双重阻断中起着重要的调节作用。TME中CD8+T细胞和NK细胞的下调可能是PD-1/TIGIT双重阻断成功的主要障碍。因此,有必要设计新的策略来增加CD226的表达和信号传递,以防止其在TME中的下调。值得注意的是,一项正在进行的临床试验是在多种癌症中测试抗CD226的激动剂(NCT04099277)。然而,由于CD226在介导血小板粘附和活化中的作用,潜在的血液学不良事件需要仔细监测。最后,使用不同工程化Fc抗TIGIT单抗的临床试验可能有助于确定FcγR协同在TIGIT阻断中的作用。
总之,TIGIT在发现后仅10年,就已经作为免疫治疗的靶点进入临床试验。随着对TIGIT介导的免疫反应调节研究的深入,将有助于针对癌症患者进行TIGIT阻断剂的优化组合策略设计,也将有助于开发靶向TIGIT疗法来治疗其他表达该蛋白的慢性疾病。
参考文献:
TIGIT in cancer immunotherapy. J Immunother Cancer 2020;8:e000957.
小编为大家收集了JP Morgan大会上各公司的演讲PPT40份,以获取大会上的热点新闻和未来风向。
扫码登记信息,即可领取下载地址!
扫 码 领 取
识别微信二维码,添加抗体圈小编,符合条件者即可加入抗体圈微信群!

本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
