
胃癌(GC)是世界上第五大常见癌症,也是癌症相关死亡的第二大原因。免疫检查点抑制剂(ICIs)、靶向程序性细胞死亡蛋白1 (PD-1)和程序性死亡配体1 (PD-L1)的出现彻底改变了癌症治疗。pembrolizumab或nivolumab单药治疗的临床试验表明,晚期胃癌的有效率约10-26%。但晚期胃癌没有选择性生物标志物,到目前为止,没有单一的生物标志物可用于充分的患者分层。为了提高抗PD -1/PD-L1治疗GC的疗效,迫切需要确定哪些患者最有可能从免疫治疗中获益。
免疫细胞的不同亚群的分布及其与癌细胞的精确位置被认为是预测肿瘤行为的有价值的指标。事实上,肿瘤微环境的组成部分可能影响治疗反应,因此,分析单个细胞和非细胞成分的空间关系可能促进开发改进肿瘤免疫生物标志物。精确识别特定的肿瘤免疫细胞亚群需要多个标记的组合。最近在多重免疫组化(m-IHC)方面的进展使在单细胞分辨率下同时原位检测多种抗原成为可能。然而,这些方法还没有被用于免疫治疗背景下GC中的免疫细胞分析;大多数分析都是使用传统的免疫组化。
本研究中,我们使用m-IHC结合数字图像分析和机器学习来识别GC临床标本的免疫细胞特征。我们描述了肿瘤浸润免疫细胞(TIICs)的密度和空间模式,以及它们的预后意义。这些数据将有助于评估抗PD -1/PD-L1治疗背景下TIICs的密度和空间模式,以便更好地理解GC对免疫治疗反应的决定因素。
结果
GC患者的临床病理特征
在2014年7月至2019年12月期间,有80名患者加入了该研究。患者的中位年龄为60岁(范围为54-66岁),大多数患者为男性(76.3%)。在接受免疫治疗的60例患者中,21例使用标准剂量抗PD -1/PD-L1抗体治疗,39例作为临床试验的一部分进行治疗(NCT03472365, NCT03713905)。10例(12.5%)患者为EBV(+), 11例(13.75%)确诊为DNA错配修复(dMMR) GC缺陷。
TIIC分布:分析概述
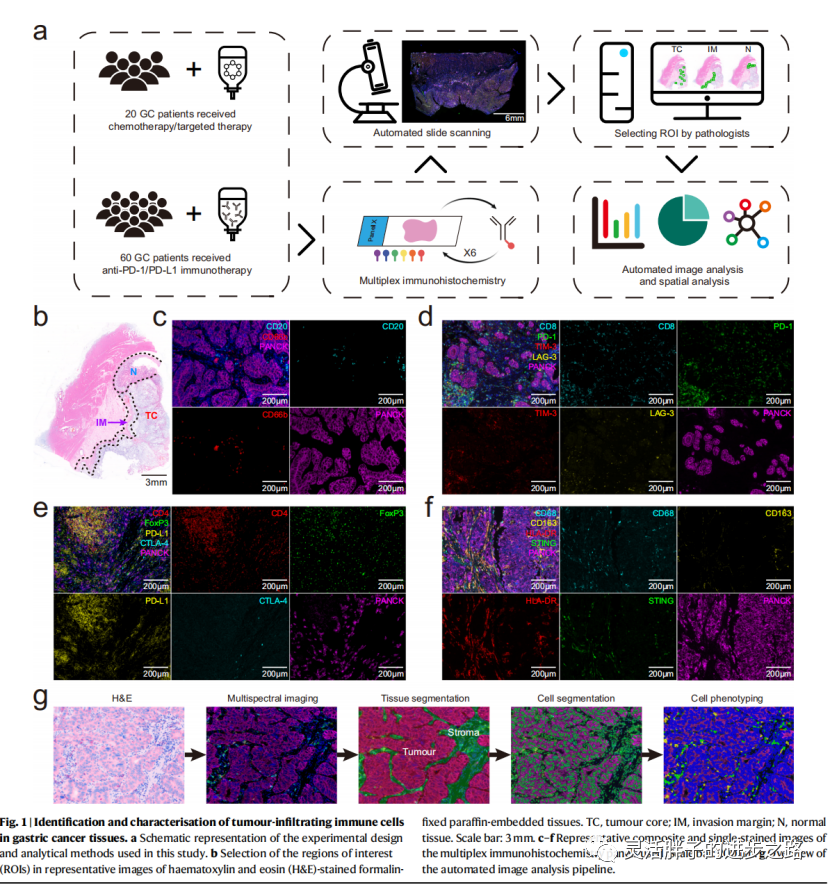
为了研究GC标本中TIICs的分布,我们通过m-IHC染色定量了80个福尔马林固定石蜡包埋(FFPE)标本中免疫细胞的密度和空间位置;对16种蛋白的亚细胞表达进行多重测定(图1a)。首先,两位病理学家检查了苏木素和伊红染色的组织切片,以确定肿瘤核心(TC)、浸润边缘(IM)和瘤周正常(N)区域,我们称之为感兴趣区域(roi)(图1b)。所分析的m-IHC面板如图1c-f所示。所有患者共成像6488个高功率场(TC: 4477, IM: 993, N: 1018)。基于机器学习,使用监督图像分析系统(inForm)将每张图像分类为肿瘤巢和基质区域(图1g)。细胞切片显示细胞核、细胞质和膜的轮廓。细胞表型数据是基于阳性和相对强度的所有标记在一个面板。计算“所有”区域(肿瘤+基质)的细胞密度,分别在肿瘤和基质中测量。随后,在单细胞水平上对TIICs进行分析,并对26个主要居群进行了特征分析。
TIIC在不同的rois上分布不同
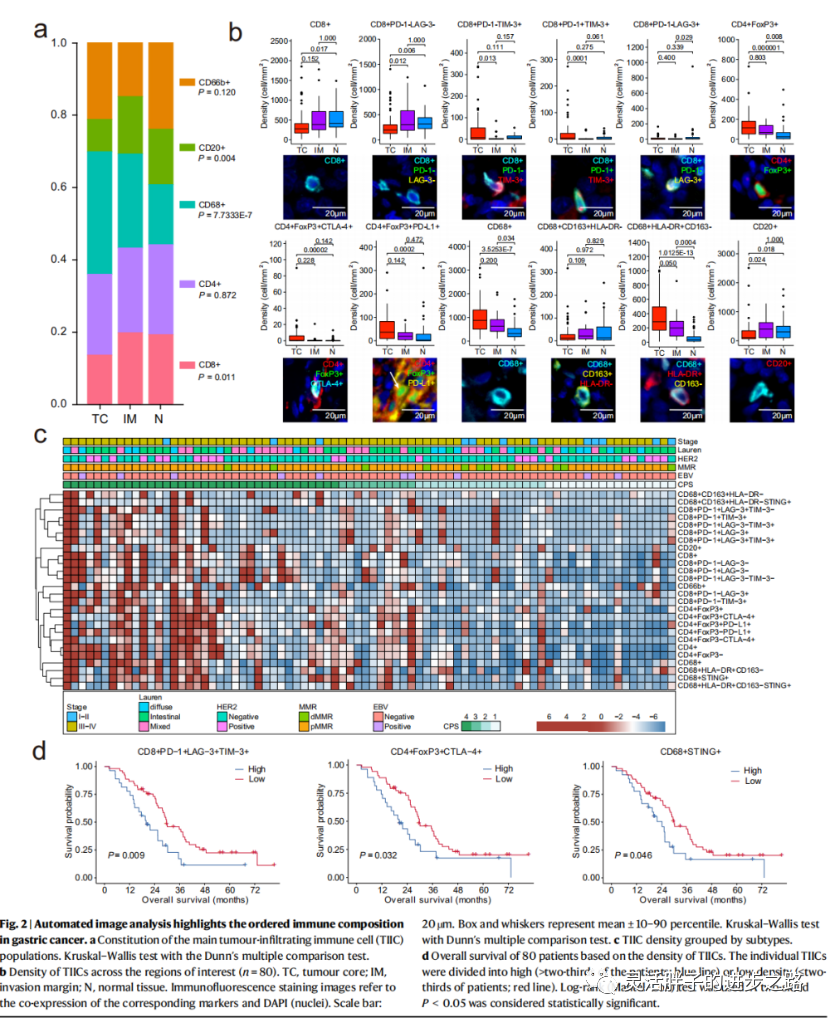
为了检查TIICs在肿瘤微环境中的分布,我们分析了它们在TC、IM和N区的空间密度。免疫群体的富集共现定义了结构化免疫环境。与邻近正常组织相比,TC内CD68+细胞总体密度显著增加;CD8+和CD20+细胞则相反(图2a)。CD8+、CD8+ PD-1−LAG-3−、CD20+和CD68+ CD163+ HLA-DR−细胞在IM期积累,在TC期减少。CD8+ PD-1+ TIM-3+、CD8+ PD-1−TIM3+、CD8+ PD-1+ LAG-3+ TIM-3+、CD8+ PD-1+ LAG-3−TIM-3+、CD4+ FoxP3+ CTLA-4+、CD4+ FoxP3−CTLA-4+、CD68+、CD68+ HLA-DR+ CD163−细胞在TC积累,向IM方向减少。有趣的是,TC内CD4+ FoxP3+和CD4+ FoxP3+ PD-L1+细胞密度高于正常组织(图2b),突出了GC中TIICs的异质性分布。此外,进一步检查了TIICs在肿瘤巢和间质区的定位。CD8+、CD4+和CD20+细胞主要位于间质中,在肿瘤巢中较少出现。相反,CD66b+细胞在肿瘤巢中比在基质中更普遍。
在不同的GC亚型中,TIICs的浸润分布是不同的
为了评估GC中的肿瘤免疫微环境,我们比较了不同临床病理因素背景下TIICs的密度(图2c)。一般来说,在Lauren分类、肿瘤分化和肿瘤位置(食管胃交界处或非食管胃交界处)之间,TIICs的密度没有显著差异。此外,her2阳性和阴性GC中TIICs的密度几乎没有差异(图2c)。总的来说,CD8+、CD4+和CD68+细胞的总密度与疾病的分期有关。晚期GC (III-IV)样本显示CD8+ T细胞、CD4+ FoxP3−细胞等衰竭细胞的密度更高。
我们分析了不同分子亚型GC中TIICs的密度。EBV阳性肿瘤CD8 +PD-1−LAG-3−T细胞密度明显高于EBV阴性细胞。EBV (+) GCs以丰富的免疫细胞浸润为特征;然而并非所有EBV(+)患者对免疫治疗都有反应,这表明需要特异性免疫细胞浸润。pMMR肿瘤显示CD4+、CD68+、CD20+和CD66b+细胞总数明显高于dMMR肿瘤。已知较高的CD68+和CD66b+细胞(中性粒细胞)有助于在几种癌症中对PD-1/PD-L1治疗产生耐药性。我们将患者分为四组(CPS): CPS <1;1≤CPS<5;5≤CPS<10;CPS≥10。
值得注意的是,TIICs(包括CD8+、CD4+、CD68+、CD20+和CD66b+细胞)的丰度随着CPS的增加而显著增加,表明肿瘤免疫环境“更热”。但CPS 5-10与CPS≥10的比较无显著性差异,为基于抗PD -1/ PD - l1治疗的临床试验的截止选择提供了证据。总之,如图2c所示,我们的结果表明,免疫细胞的浸润模式取决于但不限于GC分子亚型。
根据TIICs的浸润密度进行生存分析
接下来,我们试图了解TIICs的数量是否与患者生存率相关。我们发现,在80例患者中,较高水平的肿瘤浸润T细胞亚群,包括CD8+ PD-1+ late -3+ TIM-3+,CD4+ FoxP3+ CTLA-4+ T和CD68+ STING+细胞,与较低的总生存率(OS)相关(图2d)。CD8+ PD-1+ LAG-3+ TIM-3+细胞和CD68+ STING+细胞与OS显著相关。总的来说,这些数据强调了肿瘤浸润T细胞与胃癌患者生存的临床相关性。
GC的空间分析显示肿瘤细胞和免疫细胞的分级组织
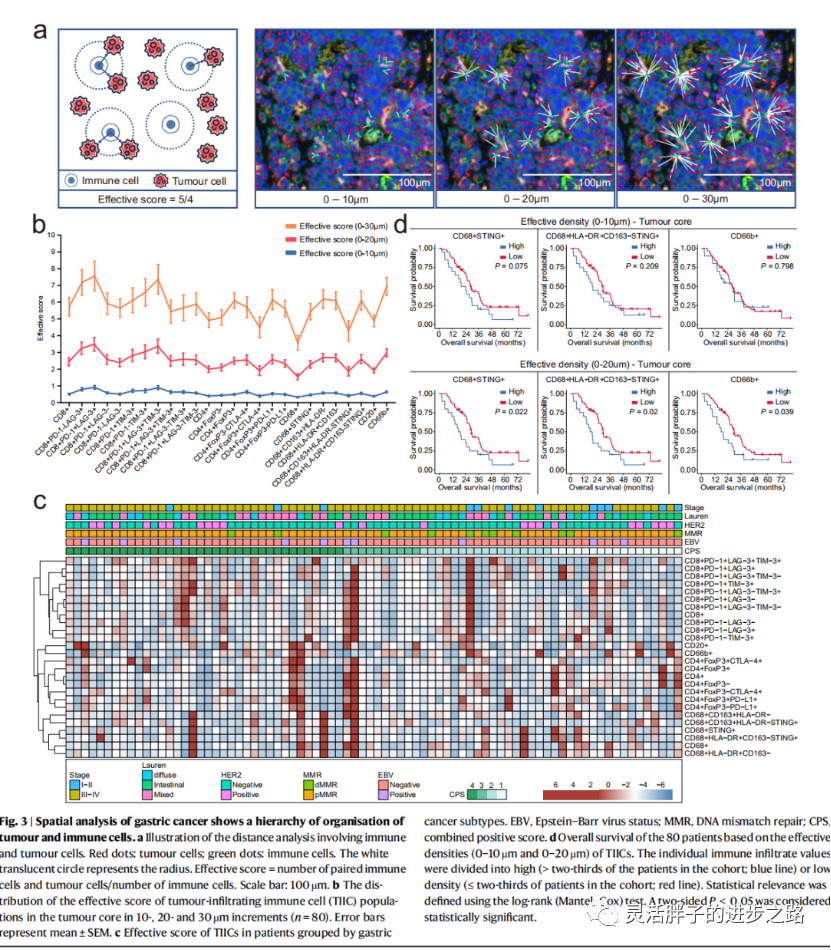
我们有能力精确定义单个肿瘤细胞和TIICs的位置,下一步试图评估它们之间的邻近性的临床意义。观察到某些TIICs,包括CD68+细胞,在肿瘤区域富集,提示TIICs接近肿瘤细胞可能影响其表型。为了进一步研究这些定位模式,生物信息学工具可确定任何两种细胞类型之间的核到核的距离。为了结合细胞的接近性和数量,建立了一个“有效得分”参数(图3 a)。换句话说,这个分数是用配对的免疫细胞和肿瘤细胞的数量除以整个幻灯片的免疫细胞总数来计算的,从而在很大程度上代表了空间的变化。使用该公式,有效评分越高,说明在一定距离内,免疫细胞周围肿瘤细胞密度越高。重要的是,在考虑的三个距离(0-10/0-20/0-30 μm)中,CD8+ PD- 1 + LAG-3+ T细胞和CD66b+中性粒细胞是有效评分较高的细胞(图3b)。
有趣的是,有效评分在不同GC分子亚型之间也存在差异,包括那些取决于EBV、PD-L1 CPS、MMR和HER2状态的得分。例如,与her2阳性GC相比,her2阴性GC中20µm半径内的衰竭T细胞(CD8+ PD-1+ lage3 + TIM-3−,CD8+ PD-1−TIM-3+)、M1 (CD68+ CD163+ HLA-DR−)和M2 (CD68+ HLA-DR+ CD163−)的有效评分显著高于her2阳性GC(图3c)。
临近癌细胞的TIICs与患者生存期相关
为了进一步的细节,有效密度(20 μ m半径内肿瘤细胞附近TIICs的绝对数量)被用作额外的测量。该半径被预先选定,以确定最有可能与肿瘤细胞有效、直接、细胞间相互作用的免疫细胞群,这与先前在多种胃肠道肿瘤类型中的研究一致。我们发现CD68+ STING+巨噬细胞、CD68+ HLA-DR+ CD163−STING+巨噬细胞和中性粒细胞有效密度(半径0-20 μ m)较高的患者,其OS明显较有效密度较低的患者短(图3d)。重要的是,在使用多变量Cox模型调整后,预后值仍然显著。其他免疫细胞表型与OS无关。这些结果表明,TIICs对患者生存的影响不仅取决于TIICs的数量,而且还取决于它们与肿瘤细胞的接近程度。总之,我们的数据强调TIIC的位置和密度都应该被考虑到预后预测。
多维TIIC特征预测免疫治疗反应
接下来,我们研究了TIICs的密度和各自的有效评分是否与抗PD-1/PD-L1免疫治疗的临床结果相关。所有60名接受免疫治疗的患者被分配到培训(n = 44)和验证(n = 16)队列中。我们确保了训练和验证队列的临床特征是平衡的(表2)。我们使用逻辑回归分析来评估TIICs和训练队列的客观应答率(ORR)之间的相关性。重要的是,我们发现CD4+ FoxP3−PD-L1+ T细胞的密度和CD8 +PD-1 +LAG-3−T细胞的有效评分与抗PD-1/PD-L1治疗的阳性反应密切相关;相反,CD8+ PD-1−LAG-3−T细胞和CD68+ STING+巨噬细胞与抗PD-1/PD-L1治疗的阴性反应密切相关。
CD4+ FoxP3−PD- l1 + T细胞、CD8+ PD-1−LAG3−T细胞和CD68+ STING+巨噬细胞的密度以及CD8+ PD-1 + LAG3−T细胞的有效评分被用来定义TIIC特征(图4a),这有可能提高识别抗PD-1/ PD- l1免疫治疗应答者的能力。我们使用了四种类型的机器学习模型,并计算了训练和验证队列的曲线下面积(AUC)。在验证队列中,四种算法的平均auc分别为0.80,0.85,0.77和0.75(图4b, c)。这表明TIIC特征确实可以用来预测免疫治疗的反应。四种算法在超参数调整前后表现出了相似的性能。此外,我们还探讨了TIIC评分结合CPS、EBV状态和MMR状态的预测能力。复合TIIC特征在ETC、GBC和ABC模型中有较好的AUC,但在MLP模型中没有。
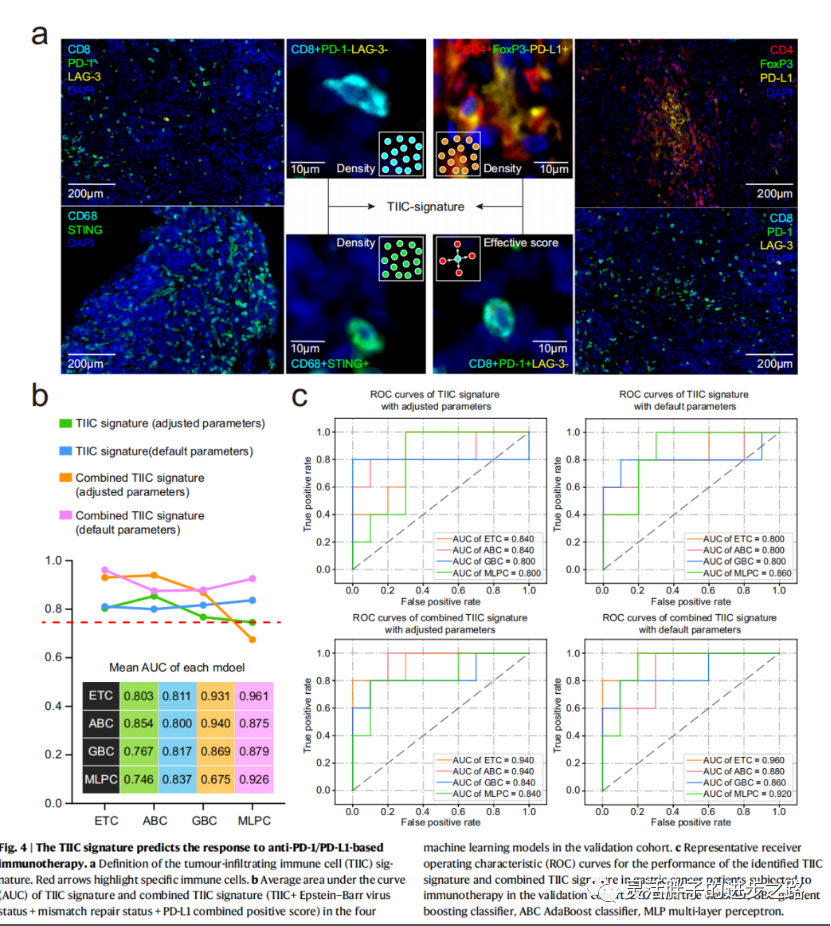
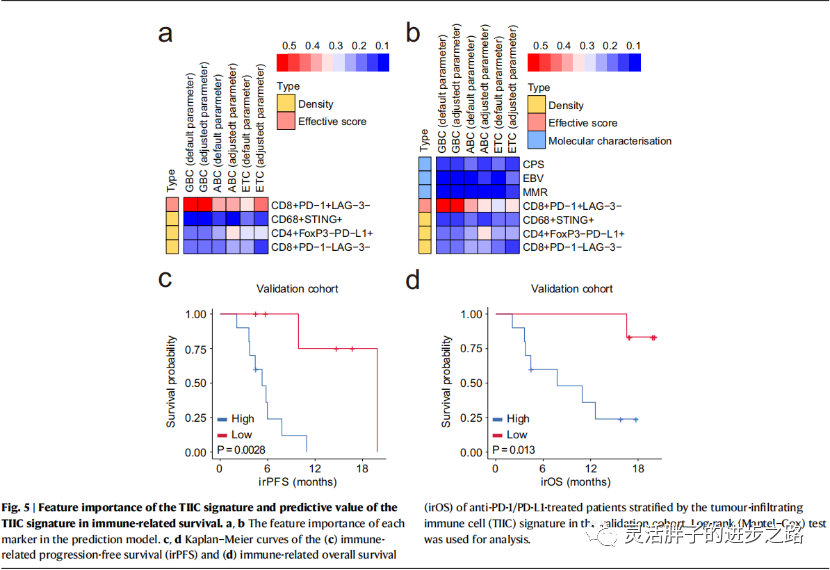
我们通过使用scikit-learn包的特征重要性来量化每个标记在预测模型中的贡献。如图5a所示,在ETC、GBC和ABC机器学习模型中,CD8+ PD-1+ LAG-3−细胞的有效评分比CD68+ STING+、CD4+ FoxP3−PD-L1+或CD8+ PD-1−LAG-3−细胞的密度具有更高的特征重要性。如图5b所示,CD8+ PD-1+ LAG-3−细胞的有效评分比其他三种免疫细胞类型EBV、MMR和PD-L1 CPS具有更高的特征重要性。因此,主要的预测标记是免疫治疗反应的空间组织。
TIIC信号在抗PD-1/PD-L1免疫治疗中的预后应用
接下来,我们研究了TIIC特征的预后作用。采用单因素Cox比例风险回归模型计算各指标的危险度。然后,我们用每个指标的HR作为权重乘以指标本身的值,然后计算出四个指标的加权和。在本分析中,我们根据TIIC特征将患者分为高、低分组。使用Kaplan-Meier方法计算两组间存活概率随时间的差异。我们观察到验证队列中免疫相关无进展生存期(irPFS)和免疫相关总生存期(irOS)存在显著差异(图5c, d)。因此,TIIC信号可能有助于识别先天表现出积极抗肿瘤免疫反应的患者。
讨论
目前临床对GC的推荐主要是根据疾病的分期和HER2、PD-L1 CPS、EBV和MSI的状态。然而,还需要更准确的预后参数来指导个性化治疗。例如,pembrolizumab、曲妥珠单抗和化疗联合治疗her2阳性晚期胃癌显示出有希望的疗效,在I-III期临床试验中,无论PD-L1状态如何,ORR均在74.4%以上。然而,抗her2和基于PD -1/ PD - l1的治疗之间协同作用的机制基础尚未明确。我们的研究结果显示,her2阴性患者中衰竭T细胞和M1、M2巨噬细胞的有效评分高于her2阳性患者,提示对免疫治疗不利的肿瘤微环境。
虽然已知CD8+ T细胞亚群与这些免疫治疗药物的作用机制有关,但在临床应用中,需要一组全面和多样化的标记物来提供相当的预后准确性。据报道,CD8+ T细胞的预后使用存在冲突,可能是因为CD8+ T细胞密度较高的患者也表现出较高的PD-L1表达。在我们的研究中,CD8+ T细胞被分为几个亚类。多种标记的结合使我们能够识别特定的肿瘤免疫细胞亚群。我们发现高密度的CD8+ PD-1+ LAG-3+ TIM-3+ T细胞和CD68+ STING+巨噬细胞与较差的OS相关,独立于潜在的混杂因素。重要的是,这些结果与弥漫性大b细胞淋巴瘤的报告一致;TIM-3+、LAG-3+和PD-1+ TIICs的高比例转化为较差的生存率。PD-1在CD8+ T细胞中的差异表达提示T细胞衰竭。事实上,肝细胞癌中CD8+ T细胞的功能分析显示,PD -1高的亚群在T细胞受体刺激下产生的肿瘤坏死因子(TNF)和/或干扰素γ (IFN-γ)最少。
此外,我们发现CD68+ STING+巨噬细胞、CD68+ HLA-DR+ CD163−STING+巨噬细胞和中性粒细胞有效密度(0-20 μ m半径)较高的患者OS明显较短。事实上,CD68+ STING+巨噬细胞的密度和有效密度都与低生存率相关。这些结果与之前的研究一致,提示STING或巨噬细胞是GC的阴性预测因子。因此,我们的研究结果进一步证实了STING的阴性预后价值,特别是在巨噬细胞亚型明确的情况下。总之,我们的研究结果支持这样一个概念,即空间标记的组合增强了GC的预后价值。
我们的主要目的是评估抗PD -1/PD-L1治疗背景下TIICs的密度和空间模式,以预测GC对免疫治疗的反应。CD4+ FoxP3−PD-L1+ T细胞的密度和CD8+ PD-1+ LAG3−T细胞的有效评分与抗PD-1/PD-L1治疗的阳性反应相关。有效评分越高,表明配对免疫细胞和肿瘤细胞除以整个幻灯片免疫细胞总数的数量越多。这些结果与之前的研究一致,表明高比例的CD8+ PD-1+ TIM-3−LAG-3−细胞与较长的中位数irPFS和较高的ORR相关。先前的报道表明,CXCL13(编码效应趋化因子)是PD-1+肿瘤浸润细胞中上调最多的基因之一;这种上调可能是吸引其他免疫细胞亚群进入肿瘤组织的基础。此外,在肿瘤-宿主界面发现了PD-1+ TILs,这表明这些细胞可能在将免疫亚群招募到肿瘤中具有积极的功能。T细胞中CD274(编码PD-L1)的缺失增强了适应性肿瘤免疫并激活TAMs,这表明抗PD -1/PD-L1抑制剂的使用将增强高密度CD4+ FoxP3−PD-L1+ T细胞肿瘤的免疫力。
有趣的是,CD8+ PD-1−LAG3−T细胞和CD68+ STING+巨噬细胞对抗PD-1/PD-L1治疗呈阴性反应。事实上,CD8+ PD-1−LAG-3−T细胞类型能够特异性识别免疫治疗反应较差的患者亚群,潜在地允许选择替代治疗方案。STING在TAMs中高表达与生存率差相关,不仅在我们的研究中如此,在之前对GC17的研究中也是如此。一项功能研究表明,抑制STING可促进巨噬细胞向促炎亚型极化,导致GC细胞凋亡。使用STING拮抗剂与PD-1阻断剂协同作用可诱导持久的抗肿瘤免疫,抑制结肠癌的腹膜播散,并最终根除癌症。由于腹膜转移是胃肠道癌的一种致命表现,因此应考虑采用相同的联合治疗策略来预防胃癌的腹膜癌。总的来说,这些观察表明肿瘤内有多层组织,并有效预测免疫治疗反应。事实上,这项研究为GC免疫的本质提供了进一步的见解。生成的信息可用于开发和优化有效的免疫治疗策略。我们的数据清楚地表明,TIICs在应对ICIs方面具有主导作用。重要的是,我们提出了一个TIIC信号来预测免疫治疗反应。
我们的研究并非没有局限性。虽然m-IHC方法无疑优于传统的IHC方法,但骨髓源性抑制细胞的一组一致的蛋白质标记尚未确定,因此标记选择上会存在差异。进一步的研究,包括空间转录组学和体内和体外验证是必要的,有可能为GC中的TIICs提供额外的生物学见解。肿瘤形成特定TIIC特征的原因是一个基本问题,值得进一步研究。此外,我们承认,我们定义的一些免疫细胞子集可以相互关联,作为具有不同表型的“子细胞”,但源自相同的“祖先细胞”。因此,有必要进行独立的研究来证实我们的发现。
相反,该研究的优势包括在所有幻灯片中获取整个肿瘤微环境,然后对离散roi进行标准化选择。我们的研究清楚地强调了计算机辅助细胞密度定量的好处,而不是单纯由病理学家对给定标记物的阳性细胞比例进行视觉评估。尽管如此,尽管我们的结果支持TIICs在GC中的预后和预测意义,但需要进一步的大队列研究,最好是来自前瞻性临床试验的研究来证实我们的发现。还需要进行比较研究,以显示使用我们在此提出的评估免疫细胞浸润的方法的明显优势。
总的来说,我们的结果强调了肿瘤免疫浸润的多维标记评价作为GC的一个强大的定量预测工具。对GC样本微环境组成的探索将为与肿瘤进展和免疫治疗反应相关的复杂和异质免疫景观提供关键的见解。