
糖皮质激素样诱导的TNF受体(GITR)为TNF受体超家族的一员,作为CD4+和CD8+初始T细胞的协同刺激分子,GITR会引起T细胞增殖和提升效应器的功能。GITR是表达于细胞毒性T细胞和Treg细胞的共刺激受体。肿瘤抗原不仅可以增加GITR表达在T细胞上的表达,而且可以活化GITR在Treg细胞上的表达。另外GITR活化能够阻断Treg细胞的抑制作用,增强细胞毒性T细胞的功能。临床前研究表明,GITR的活化有助于通过活化T细胞和抑制Treg细胞活性来增强免疫力。但是在临床中,GITR激动剂却没有展现良好的治疗效果,这可能是因为这些激动剂无法有效的诱导受体介导的多聚化,因此无法有效的激活相关信号。
为了克服这一问题,艾伯维开发了PD-1/GITR-L双效激动剂,该激动剂的可以有效的诱导GITR的多聚化,并且GITR的多聚化不依赖于抗体FcγR。临床前研究证明,该双效激动剂可以诱导T的活化,增值和记忆细胞的分化,并且在动物模型中其展现了剂量依赖性的对肿瘤的抑制。
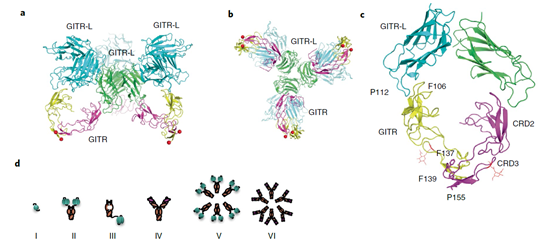
研究者解析了huGITR-L–GITR复合物的结构结果表明,GITR-L以三聚体的形式与GITR结合,而GITR以二聚体的形式与两个不同的GITR-L三聚体结合。并且结构表明,GITR-L–GITR的相互作用主要是通过GITR的103–109位氨基酸(特别是F106)和GITR-L顶部的Asn53 及 Pro112位氨基酸。
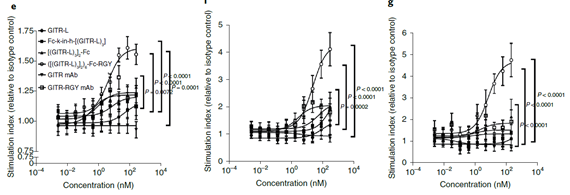
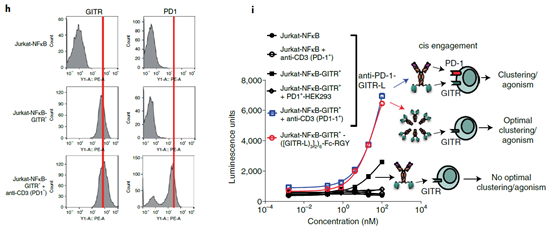
为了研究什么类型的GITR-L或者GITR激动剂可以有效的激活相关通路,研究者构建了不同形式的GITR-L的融合蛋白和不同形式的GITR激动剂抗体(下图d),这些不同结构的分子可以不同程度的诱导GITR的聚集。结果表明,RGY突变(促进形成六具体)的Fc融合GITR-L三聚体(([(GITR-L)3]2)6-Fc-RGY)具有最好的效果,且很大程度的强于RGY突变的GITR激动剂抗体(GITR-RGY mAb)。这也从侧面证明,GITR相关通路的激活可以不依赖于抗体FcγR对GITR的聚集。因此研究者构建了PD-1/GITR-L抗体融合蛋白,期望利用PD-1并通过GITR-L三聚体对GITR进行聚集并激活相关信号通路,从而激活并促进T细胞的增值。在CD3激活的NFκB-GITR+报告基因细胞中,PD-1/GITR-L对NFκB通路的激活依赖于PD-1的表达(下图h-i).
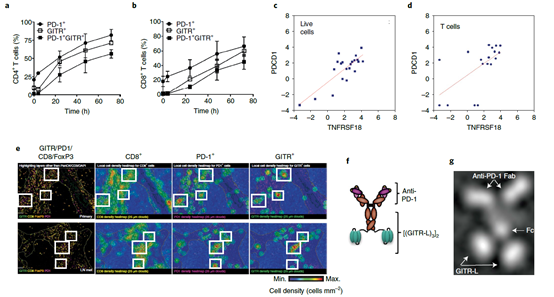
PD-1/GITR在T细胞上共表达及PD-1/GITR-L双特异分子的构建PD-1/GITR-L抗体融合蛋白能够发挥作用的基础是PD-1和GITR的共表达,研究者对PBMC的T细胞分析发现,PD-1和GITR在TCR激活的T细胞上共表达,并且其它研究也发现,PD-1和GITR同样在肿瘤浸润淋巴细胞上共表达(下图a-b)。另外,研究发现PD-1和GITR在头颈部鳞状细胞癌中的T细胞上共表达(下图c-e)。
PD-1/GITR-L抗体融合蛋白的构建采用2+2结构,其中PD-1采用的是12A11单克隆抗体,而GITR-L是以三聚体的形式融合在Fc的末端。为了Fc采用LALA突变降低Fc的相关效应功能(ADCC、CDC等)。在体外的结合活性方,PD-1/GITR-L抗体融合蛋白无论是在蛋白水平上还是在细胞水平上都能对两个靶点进行很好的结合(下图f-m)。

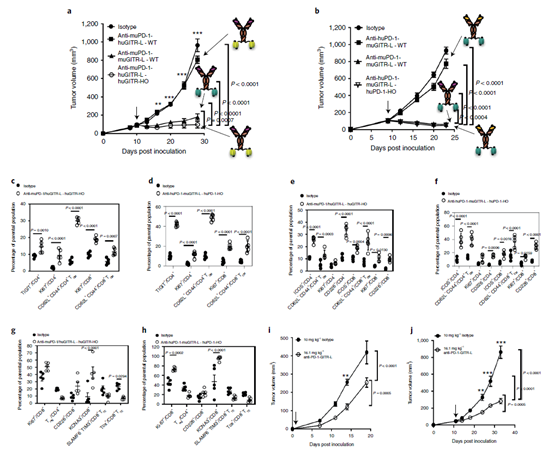
因为PD-1/GITR-L抗体融合蛋白对小鼠的PD-1和GITR没有交叉结合能力,研究者构建了PD-1或者GITR单人源化小鼠,或者两者的双人源化小鼠,并且对构建了相应的杂合抗体(anti-muPD-1-huGITR-L 或者 anti-huPD-1-muGITR-L))。在小鼠模型中,这些杂合抗体仅对对应的单人源化的小鼠具有疗效(下图a-b),该结果从侧面表明,该抗体融合蛋白的发挥药效需要两个对两个靶点的同时结合。同样,在双靶点人源化小鼠模型中,PD-1/GITR-L同样具有抑制肿瘤生长的效果(下图i-j).
经过PD-1/GITR-L抗体融合蛋白治疗后,小鼠血液中的TIGIT+CD4+, Ki67+,TCM CD4+ 和CD8+ T细胞数量增加。在肿瘤中,Ki67+, CD226+和 KCNA3+ CD8T细胞的数量增加,而SLAMF6–TIM3+ Treg 和CD8+ TTE (疲惫的T细胞) 数量降低(下图c-h)。
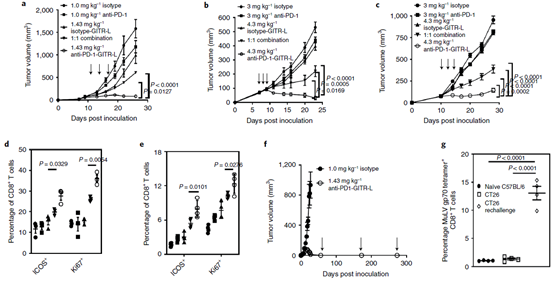
PD-1/GITR-L抗体融合蛋白与联合用药机制不同在多种肿瘤模型中如CT26, EMT6 和JC,PD-1/GITR-L抗体融合蛋白对肿瘤的抑制效果都显著的优于PD-1和GITR-L联合用药的效果(下图a-c),并且经过PD-1/GITR-L抗体融合蛋白治疗的小鼠,后期再次接种后肿瘤后同样可以完全抑制肿瘤细胞的生长(下图f)。对PD-1/GITR-L抗体融合蛋白治疗后的小鼠分析发现,其分泌GZMB+的CD8+T细胞数量增加(下图h-i),并且IHC分析发现,在治疗组分泌GZMB+的细胞数量明显提高,而其中CD8+ T细胞的数量明显高于NK细胞的数量(下图j-k),这表明PD-1/GITR-L主要是通过CD8T细胞发挥作用。后续在小鼠肿瘤模型中,通过分别去除CD8T或者CD4T细胞同样证明PD-1/GITR-L通过CD8T发挥作用,而PD-1+GITR-L联合主要是通过CD4T细胞发挥抑制肿瘤生长的作用(下图l)。在基因层面分析发现,PD-1/GITR-L治疗后CD8a 和 GZMB的表达升高,而这两者对CD8T细胞的肿瘤浸润以及细胞毒性至关重要(下图m-n)。
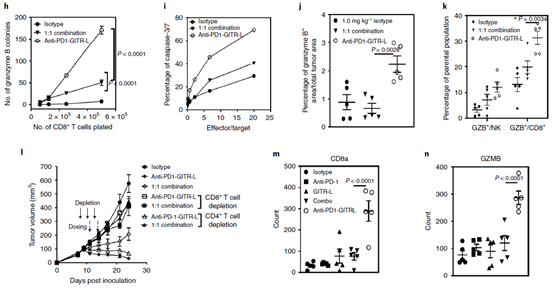
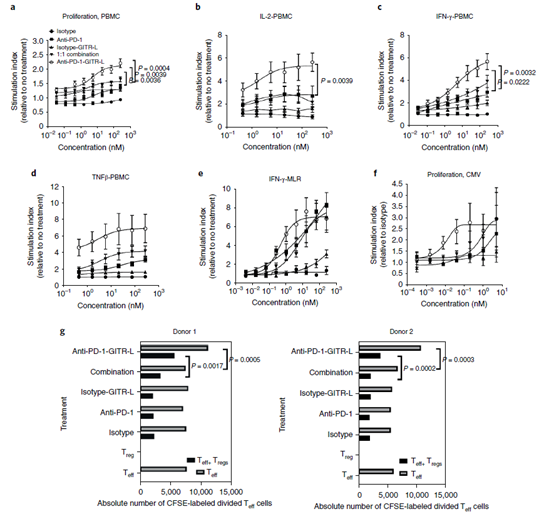
在细胞因子是否层面,PD-1/GITR-L可以刺激人PBMC分泌更多的IFN-γ, IL-2 和 TNF-β。另外,PD-1/GITR-L治疗可以显著的增加Teff(效应T细胞CD4+CD25–)抑制Treg细胞的抑制作用(下图g)。
免疫检查点抑制剂已经在临床中取得了巨大的成功,但是免疫激动型药物的开发却步履维艰,其可能是多方面的原因,如以抗体为基础的激动型药物无法促使TNFR有效的聚集,非特异激活诱导的治疗毒性等。而糖皮质激素样诱导的TNF受体(GITR)做为TNF受体超家族的一员,临床中以此位靶点的激动型抗体疗效也相当有限。Abbive依据T细胞表面同时表达PD-1和GITR的特性,开发了能够同时靶向PD-1和GITR的抗体融合蛋白PD-1/GITR-L。临床前研究表明,该双效激动型抗体发挥药效依赖于对PD-1的结合,抗体对T细胞表面PD-1的结合有效的促进GITR-L与GITR的结合并促使GITR的多聚体复合物的形成,从而促进T细胞的活化和增值。
在动物模型中,该双效激动型抗体融合蛋白展现了较好的药效,而且能保护小鼠再次接受肿瘤的挑战。这主要是PD-1/GITR-L治疗可以减少肿瘤中耗竭的TOX+CD8+ T细胞,减少Treg细胞的数量,并增加GZMB CD8T细胞的含量。

在以抗体为基础的激动型药物开发受阻的情况下,目前已经有多家公司已经在尝试利用融合蛋白的进行激动剂的开发,如罗氏开发了4-1BBL的双效抗体。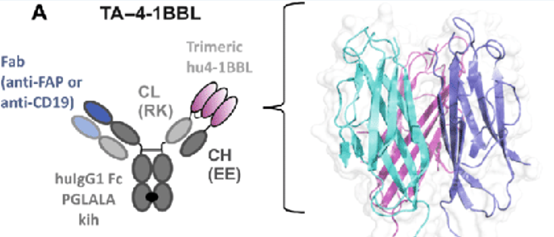
ABBV-621是艾伯维目前正在Ⅰ期临床的TRAIL三聚体药物, ABBV-621中的TRAIL三聚体位单链,三个单体通过linker连接,同时末端与Fc融合,因此其最终产物是含有两个TRAIL三聚体的融合蛋白。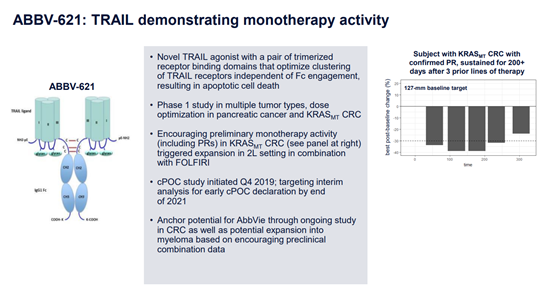
国内三叶草生物的SCB-313是利用Trimer-Tag™构建的三聚体TRAIL融合蛋白,其稳定性主要依靠C末端的Trimer-Tag™,并且该Trimer-Tag™同时增加了融合蛋白的分子量,进而增加了其半衰期。临床前研究表明,SCB-313静脉注射半衰期高于TRAIL单体(类似于Dulanermin)的三倍以上(20min VS 6min),腹腔注射半衰期更长,约为3小时。(文末添加小编微信获取相关资料)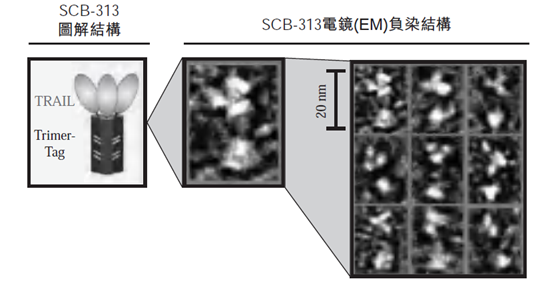
Sarah Chan, Nicole Belmar, Sun Ho et al. An anti-PD-1–GITR-L bispecific agonist induces GITR clustering-mediated T cell activation for cancer immunotherapy. Nat ure Cancer 2022

识别微信二维码,添加抗体圈小编,符合条件者即可加入抗体圈微信群!

本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
